题目内容
【题目】在2L密闭容器内,800℃时NO(g)和O2(g)反应生成NO2(g)的体系中,n(NO)随时间的变化如表所示:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应,在第5s时,NO的转化率为________。
(2)如图中表示O2变化曲线的是________,用O2表示从0~2s内该反应的平均速率v=________。
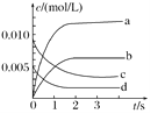
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内气体总质量保持不变
c.v逆(NO)=2v正(O2) d.容器内气体密度保持不变
【答案】是 65% d 0.0015mol/(Ls) c
【解析】
(1)根据表格中的数据,从3s开始n(NO)保持0.007mol不变,反应物NO没有反应完全,故该反应是可逆反应;5s时NO的转化率为![]() ;
;
(2)对于可逆反应2NO(g)+O2(g)![]() 2NO2(g),由表中数据可知,反应加入的NO的浓度为
2NO2(g),由表中数据可知,反应加入的NO的浓度为![]() ,曲线c的起始浓度为0.01mol/L,故曲线d表示O2的浓度变化;由图中数据可知2s内,NO的浓度变化量为0.01mol/L-0.004mol/L=0.006mol/L,故v(NO)=
,曲线c的起始浓度为0.01mol/L,故曲线d表示O2的浓度变化;由图中数据可知2s内,NO的浓度变化量为0.01mol/L-0.004mol/L=0.006mol/L,故v(NO)=![]() ,根据速率之比等于化学计量数之比,故
,根据速率之比等于化学计量数之比,故![]() ;
;
(3)a.无法判断正、逆反应速率是否相等,a不能说明;
b.根据质量守恒定律,反应前后气体的质量不变,故不能判定是否平衡,b不能说明;
c.v逆(NO)=2v正(O2)时,说明正、逆反应速率相等,反应达到平衡状态,c能说明;
d.恒容容器,反应物、生成物都是气体,气体质量不变,所以密度![]() 不变,不能判定是否平衡,d不能说明。
不变,不能判定是否平衡,d不能说明。
故选c。

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案【题目】下图是元素周期表的一部分,根据① ~ ⑨在周期表中的位置按题目要求回答:
族 周期 | IA | 0 | ||||||||
1 | ⅡA | …… …… …… | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
2 | ① | ② | ||||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||||
4 | ⑧ | ⑨ | ⑩ | |||||||
(1)画出⑩的原子结构示意图_________________________
(2)①与②形成的一种化合物甲,甲在大气含量过高会产生温室效应,写出甲物质的结构式 __________________________________。
(3)元素③⑤对应的最高价氧化物的水化物,写出它们相互之间能发生反应化学方程式__________________。
(4)元素⑦和⑨形成的化合物乙,请用电子式表示物质乙的形成过程__________________。
(5)②、⑥分别形成的两种氢化物中,沸点较高的是______(填化学式),原因是:___________________________________________________ 。