题目内容
10.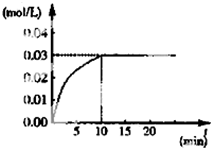 在某一容积为5L的体积不变的密闭容器内,加入 0.3mol的CO和0.3mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,反应中CO2的浓度随时间变化情况如图:
在某一容积为5L的体积不变的密闭容器内,加入 0.3mol的CO和0.3mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,反应中CO2的浓度随时间变化情况如图:(1)根据图上数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)=0.003mol/(L•min),该温度(800℃)下的平衡常数K=1.
(2)在体积不变的条件下,改变下列条件重新达到平衡时能使平衡常数K增大的有A(填字母)
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 G.移出一氧化碳气体
(3)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol 的水蒸气,重新达到平衡后,H2O的转化率降低(填“升高”、“降低”还是“不变”).
(4)在催化剂存在和800℃的条件下,在某一时刻测得c(CO)=c(H2O)=0.09mol/L,
c(CO2 )=c(H2)=0.13mol/L,则此反应是否处于平衡状态:否(填“是”或“否”),若没处于平衡状态则该反应向逆方向方向移动.(填“正反应”或“逆反应”)
分析 (1)根据CO2的浓度变化求出CO的浓度变化,再求反应速率;根据平衡常数指各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值进行解答;
(2)平衡常数只随温度的变化而变化,根据温度对平衡的影响分析;
(3)可逆反应中增大一种反应物的浓度,则另一种反应物的转化率会增大,而本身转化率减小;
(4)根据Qc=$\frac{c(CO{\;}_{2})•c(H{\;}_{2})}{c(CO)•c(H{\;}_{2}O)}$与平衡常数K的大小关系判断.
解答 解:(1)在某一容积为5L的密闭容器内,加入0.3mol的CO和0.3mol的H2O,则起始浓度c(CO)=0.06mol/L,c(H2O)=0.06mol/L,平衡时c(CO2)=0.03mol/L,则 CO(g)+H2O(g)?CO2(g)+H2(g)
起始浓度/mol•L-1 :0.06 0.06 0 0
转化浓度/mol•L-1 :0.03 0.03 0.03 0.03
平衡浓度/mol•L-1 :0.03 0.03 0.03 0.03
反应开始至达到平衡时,转化的CO为c(CO)=0.03mol/L,则v(CO)=$\frac{0.03mol/L}{10min}$=0.003mol/(L•min)-1;
K=$\frac{c(CO{\;}_{2})•c(H{\;}_{2})}{c(CO)•c(H{\;}_{2}O)}$=$\frac{0.03×0.03}{0.03×0.03}$=1;
故答案为:0.003;1;
(2)平衡常数只随温度的变化而变化,已知CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,则升高温度平衡正向移动,K增大;
故答案为:A;
(3)可逆反应中增大一种反应物的浓度,则另一种反应物的转化率会增大,而本身转化率减小,所以若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol 的水蒸气,重新达到平衡后,H2O的转化率降低;故答案为:降低;
(4)在催化剂存在和800℃的条件下,在某一时刻测得C(CO)=C(H2O)=0.09mol/L,C(CO2 )=C(H2)=0.13mol/L,
Qc=$\frac{c(CO{\;}_{2})•c(H{\;}_{2})}{c(CO)•c(H{\;}_{2}O)}$=$\frac{0.13×0.13}{0.09×0.09}$=2.1>K=1,则反应逆向进行,
故答案为:否;逆方向.
点评 本题考查了反应速率的计算、化学平衡有关计算、化学平衡移动与影响因素、K的应用等,注意把握平衡常数的应用、平衡移动的本质是解答的关键,题目难度中等.

 习题精选系列答案
习题精选系列答案| A. | 浓氢氧化钠溶液中加入铝Al+2OH-═AlO2-+H2↑ | |
| B. | 氯化铝溶于水发生水解Al3++3H2O═Al(OH)3+3H+ | |
| C. | 明矾溶液中加入少量的氢氧化钡溶液Al3++3OH-═Al(OH)3↓ | |
| D. | 硫酸铝溶液中加入过量氢氧化钠溶液Al3++4OH-═AlO2-+2H2O |
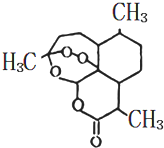 我国科学家屠呦呦因发现并成功提取出青蒿素(一种治疗疟疾的药物)而获得2015年诺贝尔生理学或医学奖.青蒿素结构简式如图(结构中有过氧键,与H2O2有相似的化学性质),下列关于青蒿素的说法不正确的是( )
我国科学家屠呦呦因发现并成功提取出青蒿素(一种治疗疟疾的药物)而获得2015年诺贝尔生理学或医学奖.青蒿素结构简式如图(结构中有过氧键,与H2O2有相似的化学性质),下列关于青蒿素的说法不正确的是( )| A. | 属于有机物 | |
| B. | 青蒿素具有一定的氧化性 | |
| C. | 青蒿素化学式为C15H20O5 | |
| D. | 青蒿素在一定的条件下能与NaOH溶液反应 |
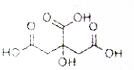 物质X的结构式如图所示,常被用于香料或作为饮料的酸化剂,在食品和医学上用作多价整合剂,也是化学中间体.下列关于物质X的说法正确的是( )
物质X的结构式如图所示,常被用于香料或作为饮料的酸化剂,在食品和医学上用作多价整合剂,也是化学中间体.下列关于物质X的说法正确的是( )| A. | X分子式C6H7O7 | |
| B. | 1mol物质X可以和3mol氢气发生加成 | |
| C. | X可以发生氧化反应、取代反应和消去反应 | |
| D. | 1molX分别与足量的NaHCO3、Na反应得到的气体体积比为3:2 |
| A. | pH=4的醋酸 | B. | pH=10的NaOH溶液 | ||
| C. | pH=9的Na2CO3溶液 | D. | pH=2的硫酸 | ||
| E. | pH=4的NH4Cl溶液 |