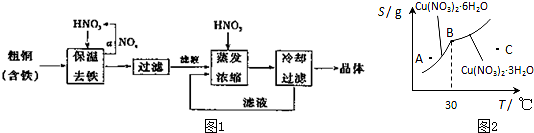
题目内容
9.常温下,某溶液中由水电离出的c (OH-)=1.0×10-10mol/L,该溶液可以是 ( )| A. | pH=4的醋酸 | B. | pH=10的NaOH溶液 | ||
| C. | pH=9的Na2CO3溶液 | D. | pH=2的硫酸 | ||
| E. | pH=4的NH4Cl溶液 |
分析 酸或碱、强酸酸式盐抑制水电离,含有弱离子的盐促进水电离,常温下水电离出的c(H+)=c(OH-)=10-7mol/L,某溶液中由水电离出的c (OH-)=1.0×10-10mol/L,水的电离被抑制,说明溶液中的溶质为酸、碱或强酸酸式盐,酸溶液中氢氧根离子完全由水电离,碱溶液中氢离子完全由水电离,根据各选项PH进行分析解答.
解答 解:A.pH等于4的醋酸溶液中,c(H+)=10-4mol/L,对水的电离起到抑制作用,酸溶液中氢氧根离子完全由水电离,水电离出的c (OH-)=$\frac{1{0}^{-14}}{1{0}^{-4}}$=1.0×10-10mol/L,故A正确;
B.pH=10的NaOH溶液中,c(H+)=10-10mol/L,对水的电离起到抑制作用,碱溶液中氢离子完全由水电离,水电离出的c (OH-)=c(H+)=1.0×10-10mol/L,故B正确;
C.Na2CO3属于强碱弱酸盐,促进水电离,pH=9的Na2CO3溶液中,c(H+)=10-9mol/L,水电离出的c (OH-)=$\frac{1{0}^{-14}}{1{0}^{-9}}$=10-5mol/L,故C错误;
D.pH=2的硫酸溶液中,c(H+)=10-2mol/L,对水的电离起到抑制作用,酸溶液中氢氧根离子完全由水电离,水电离出的c (OH-)=$\frac{1{0}^{-14}}{1{0}^{-2}}$=1.0×10-12mol/L,故D错误;
E.NH4Cl属于强酸弱碱盐,促进水电离,pH=4的NH4Cl溶液中,c(H+)=10-4mol/L,水电离出的c (OH-)=c(H+)=10-4mol/L,故E错误;
故选AB.
点评 本题以水的电离为载体考查溶液pH的计算,明确促进或抑制水电离物质是解本题关键,注意溶液中氢离子浓度与水电离出氢离子浓度关系,题目难度中等.

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案| A. | 光导纤维--硅酸盐材料 | B. | 透明饮料瓶--合金材料 | ||
| C. | 纯棉织物--合成纤维材料 | D. | 橡胶轮胎--有机高分子材料 |
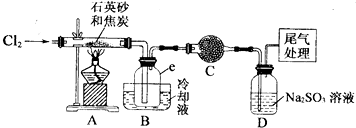
实验过程中;石英砂中的铁、铝等杂质也能转化为相应氯化物,SiCl4,A1C13,FeC13遇水均易水解,有关物质的物理常数见下表:
| 物质 | SiCl4 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | 315 | |
| 熔点/℃ | -70.0 | ||
| 升华温度/℃ | 180 | 300 |
(I)实验室制备氯气有以下五步操作,其正确操作顺序为④③⑤②①(填标号).
①向烧瓶中装入二氧化锰固体,向分液漏斗中加入浓盐酸
②检查装置的气密性
③把酒精灯放在铁架台上,根据酒精灯火焰确定铁圈高度,固定铁圈,放上石棉网
④在烧瓶上装好分液漏斗,安装好导气管
⑤将烧瓶固定在铁架台上
(2)装置A的硬质玻璃管中发生主要反应的化学方程式是2C+SiO2+2Cl2$\frac{\underline{\;高温\;}}{\;}$SiCl4+2CO↑
置A.B间导管短且粗的原因是防止生成物的AlCl3、FeCl3等杂质凝结成固体堵塞导管
验中尾气处理的方法是连接一个加热的装有CuO粉末的反应管
(3)装置B中e瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氛化硅.在精馏过程中,不可能用到的仪器有CD(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶 D球形冷凝管 E.接收器
(4)装置D中的Na2S03的作用主要是吸收未反应完的Cl2请设计一个实验,证明装置D中的Na2S03已被氧化(简述实验步骤):取少量溶液置于洁净的试管中,向其中滴加稀盐酸至不再产生气体(1分),再向其中滴入氯化钡溶液,若产生白色沉淀,证明亚硫酸钠被氧化
(5)SiCl4极易水解,其完全水解的产物为H4SiO4(或H2SiO3)和HCl.H2还原SiCl4制得高纯硅的过程中若混入O2,可能引起的后果是可能引起爆炸、硅被氧化得不到高纯硅.
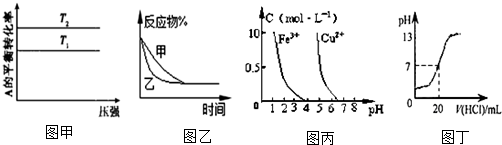
| A. | 图甲可以判断出反应 A(g)+B(g)?2C(g) 的△H<0,T2>T1 | |
| B. | 图乙表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强比甲的压强大 | |
| C. | 据图丙,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH≈4.5 | |
| D. | 图丁表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入盐酸体积的变化 |
| A. | 向其中加入NaOH溶液,平衡逆向移动,c(OH-)降低 | |
| B. | 向其中加入NaHSO4固体,c(OH-)降低,Kw不变 | |
| C. | 向其中加入固体NH4Cl,平衡逆向移动,c(H+)降低 | |
| D. | 将水稀释,Kw不变,PH增大 |
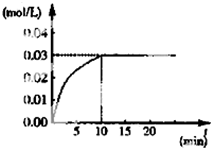 在某一容积为5L的体积不变的密闭容器内,加入 0.3mol的CO和0.3mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,反应中CO2的浓度随时间变化情况如图:
在某一容积为5L的体积不变的密闭容器内,加入 0.3mol的CO和0.3mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,反应中CO2的浓度随时间变化情况如图: