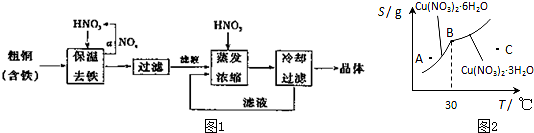
题目内容
18.页岩气是一种从页岩层中开采出来的气体资源.以页岩气的主要成分A为原料可合成一种重要的化工产品--乌洛托品,其合成路线如下:
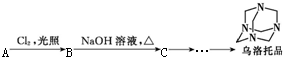
已知A是一种烃,所含碳的质量分数为75%,B的相对分子质量为50.5.
(1)乌洛托品的化学式为C6H12N4
(2)A→B 的化学方程式为取代反应,其反应类型为CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl
(3)金刚烷和1,3,5,7-四甲基金刚烷(如图)都是结构与乌洛托品相似的有机物,金刚烷与1,3,5,7-四甲基金刚烷的相对分子质量相差56

(4)将甲醛(HCHO)水溶液与氨水混合蒸发也可制得乌洛托品.若原料完全反应生成乌洛托品,则甲
醛与氨的物质的量之比为C
A.1:1 B.2:3 C.3:2 D.2:1.
分析 A是一种烃,所含碳的质量分数为75%,则A为CH4,A在光照条件下与氯气发生取代反应生成B,B的相对分子质量为50.5,所以B为CH3Cl,B在碱性条件下发生水解得C为CH3OH,
(1)根据乌洛托品的结构简式可写出其化学式;
(2)A在光照条件下与氯气发生取代反应生成B,根据元素守恒书写化学方程式;
(3)根据金刚烷的结构简式与1,3,5,7-四甲基金刚烷的结构简式可知,两分子之间相差四个CH2,据此答题;
(4)甲醛(HCHO)水溶液与氨水混合蒸发也可制得乌洛托品的反应方程式为6HCHO+4NH3= +6H2O,根据方程式可计算出甲醛与氨的物质的量之比.
+6H2O,根据方程式可计算出甲醛与氨的物质的量之比.
解答 解:A是一种烃,所含碳的质量分数为75%,则A为CH4,A在光照条件下与氯气发生取代反应生成B,B的相对分子质量为50.5,所以B为CH3Cl,B在碱性条件下发生水解得C为CH3OH,
(1)根据乌洛托品的结构简式可知其化学式为C6H12N4,
故答案为:C6H12N4;
(2)A在光照条件下与氯气发生取代反应生成B,反应的方程式为CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl,
故答案为:取代反应;CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl;
(3)根据金刚烷的结构简式与1,3,5,7-四甲基金刚烷的结构简式可知,两分子之间相差四个CH2,所以金刚烷与1,3,5,7-四甲基金刚烷的相对分子质量相差56,
故答案为:56;
(4)甲醛(HCHO)水溶液与氨水混合蒸发也可制得乌洛托品的反应方程式为6HCHO+4NH3= +6H2O,所以甲醛与氨的物质的量之比为3:2,故选:C.
+6H2O,所以甲醛与氨的物质的量之比为3:2,故选:C.
点评 本题考查有机物推断,需要学生充分利用元素含量、相对原子质量综合分析各物质含有的官能团,难度中等.

(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是BD.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡向右(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ 的比值将减小(填“增大”、“减小”或“无法确定”).
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)< V(乙)( 填“>”、“<”或“=”).
(4)已知25℃时,两种酸的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K1 | 1.8×10-5 | 4.3×10-7 | 3.0×10-8 |
| K2 | -- | 5.6×10-11 | -- |
A.HCO3- B.CO32- C.ClO- D.CH3COO-
(5)常温下,取甲溶液稀释100倍,其pH=4;取99mL甲溶液与1mL1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH=10.
| A. | A和B分子中碳原子个数一定相同 | B. | A和B不可能是同系物 | ||
| C. | A和B中氢元素质量分数一定相同 | D. | A和B的化学性质一定相似 |
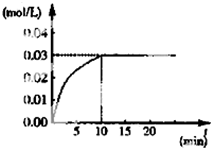 在某一容积为5L的体积不变的密闭容器内,加入 0.3mol的CO和0.3mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,反应中CO2的浓度随时间变化情况如图:
在某一容积为5L的体积不变的密闭容器内,加入 0.3mol的CO和0.3mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,反应中CO2的浓度随时间变化情况如图:
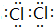 ,G的化学式是NaAlO2.
,G的化学式是NaAlO2.