题目内容
(14分)氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布式是_________________。
(2)C、N、O三种元素第一电离能从大到小的顺序是____________。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是_______________;N2H4分子中氮原子轨道的杂化类型是___________。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1
若该反应中有4mol N-H键断裂,则形成的π键有________mol。
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在__________(填标号)
a. 离子键 b. 共价键 c. 配位键 d. 范德华力
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。

下列分子或离子中,能被该有机化合物识别的是_________(填标号)。
a. CF4 b. CH4 c. NH4+ d. H2O
(1)基态氮原子的价电子排布式是_________________。
(2)C、N、O三种元素第一电离能从大到小的顺序是____________。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是_______________;N2H4分子中氮原子轨道的杂化类型是___________。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1
若该反应中有4mol N-H键断裂,则形成的π键有________mol。
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在__________(填标号)
a. 离子键 b. 共价键 c. 配位键 d. 范德华力
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。

下列分子或离子中,能被该有机化合物识别的是_________(填标号)。
a. CF4 b. CH4 c. NH4+ d. H2O
(1)2s22p3 (2)N>O>C
(3)①三角锥形 sP3 ②3 ③d (4)c (各2分)
(3)①三角锥形 sP3 ②3 ③d (4)c (各2分)
(1)根据构造原理可写出基态氮原子的价电子排布式是2s22p3。
(2)非金属性越强,第一电离能越大。但由于N中的2p是半充满,稳定性强,所以第一电离能大于O的,顺序为N>O>C。
(3)①NH3分子中中心原子含有1对孤对电子,所以是三角锥形结构。NH3中氮原子轨道的杂化类型是sp3,而肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的,所以N2H4分子中氮原子轨道的杂化类型是sp3,这个与H2O,H2O2中O的杂化类型都是sp3的道理是一样的。②根据反应式可知,当反应中有4mol N-H键断裂时,必然会生成1.5mol氮气。由于三键中含有2个π键,所以形成的π键有3mol。
③硫酸铵是离子化合物,含有离子键、极性键、配位键。但没有范德华力。所以答案选d。
(4)要形成氢键,就要掌握形成氢键的条件:一是要有H原子,二是要电负性比较强,半径比较小的原子比如F、O、N等构成的分子间形成的特殊的分子间作用力。符合这样的选项就是c和d,但题中要求形成4个氢键,氢键具有饱和性,这样只有选c
(2)非金属性越强,第一电离能越大。但由于N中的2p是半充满,稳定性强,所以第一电离能大于O的,顺序为N>O>C。
(3)①NH3分子中中心原子含有1对孤对电子,所以是三角锥形结构。NH3中氮原子轨道的杂化类型是sp3,而肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的,所以N2H4分子中氮原子轨道的杂化类型是sp3,这个与H2O,H2O2中O的杂化类型都是sp3的道理是一样的。②根据反应式可知,当反应中有4mol N-H键断裂时,必然会生成1.5mol氮气。由于三键中含有2个π键,所以形成的π键有3mol。
③硫酸铵是离子化合物,含有离子键、极性键、配位键。但没有范德华力。所以答案选d。
(4)要形成氢键,就要掌握形成氢键的条件:一是要有H原子,二是要电负性比较强,半径比较小的原子比如F、O、N等构成的分子间形成的特殊的分子间作用力。符合这样的选项就是c和d,但题中要求形成4个氢键,氢键具有饱和性,这样只有选c

练习册系列答案
相关题目

 号元素的核外电子排布式_______________________________________;
号元素的核外电子排布式_______________________________________;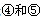 第一电离能的大小关系为________________(用元素符号表示)
第一电离能的大小关系为________________(用元素符号表示)