题目内容
部分中学化学常见元素原子结构及性质如表所示
(1)A原子中的电子占有______个轨道,最外层有______种不同运动状态的电子。这五种元素的原子半径由大到小的顺序为_________________(用元素符号表示)。
(2)E与D可以按原子个数比2:1、1:1形成两种化合物X、Y,区别X、Y这两种物质的实验方法为______________________________________。E与C组成的两种化合物M、N,所含电子数分别与X、Y相等,M的空间构型为___________,N的结构式为___________。
(3)C与D都是较活泼的非金属元素,用一个有关的化学方程式说明两种单质的氧化性强弱_____________________________________。
(4)有人认为A、B的单质用导线连接后插入NaOH溶液中可形成原电池,你认为是否可行,若可以,写出负极的电极反应式(若认为不行可不写)________________________。
| 序号 | 元素 | 结构及性质 |
| ① | A | A在第三周期中简单离子半径最小 |
| ② | B | B原子最外层电子数是内层电子数的1/5 |
| ③ | C | C是常用化肥的主要元素,单质常温下呈气态 |
| ④ | D | 通常情况下,D没有正化合价,A、B、C都能与D形成化合物 |
| ⑤ | E | E在周期表中可以排在IA族,也可以排在ⅦA族 |
(2)E与D可以按原子个数比2:1、1:1形成两种化合物X、Y,区别X、Y这两种物质的实验方法为______________________________________。E与C组成的两种化合物M、N,所含电子数分别与X、Y相等,M的空间构型为___________,N的结构式为___________。
(3)C与D都是较活泼的非金属元素,用一个有关的化学方程式说明两种单质的氧化性强弱_____________________________________。
(4)有人认为A、B的单质用导线连接后插入NaOH溶液中可形成原电池,你认为是否可行,若可以,写出负极的电极反应式(若认为不行可不写)________________________。
(1)7, 3, Mg>Al>N>O>H
(2)加入MnO2放出气体等合理即可, 三角锥型,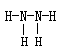
(3)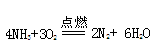 (4)Al-3e+4OH-=AlO2-+2H2O
(4)Al-3e+4OH-=AlO2-+2H2O
(2)加入MnO2放出气体等合理即可, 三角锥型,
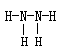
(3)
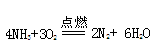 (4)Al-3e+4OH-=AlO2-+2H2O
(4)Al-3e+4OH-=AlO2-+2H2O根据元素的结构及有关性质可知,A是Al,B是Mg,C是N,D是O,E是H。
(1)根据构造原理可知,Al原子的核外电子占有7个轨道,最外层电子数是3,因此含有3种运动状态不同的电子。由于同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,所以原子半径大小顺序为Mg>Al>N>O>H。
(2)X和Y分别的是H2O和H2O2,由于H2O2可以分解生成氧气,所以区别的方法是加入MnO2放出气体的是双氧水。电子数相等的分别是氨气和N2H4,氨气是三角锥形,N2H4的结构式是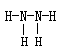 。
。
(3)非金属性强的元素能置换出非金属性弱的,即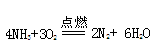 。
。
(4)由于单质铝能和氢氧化钠溶液反应,所以可以原电池,铝是负极,所以电极反应式为Al-3e+4OH-=AlO2-+2H2O。
(1)根据构造原理可知,Al原子的核外电子占有7个轨道,最外层电子数是3,因此含有3种运动状态不同的电子。由于同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,所以原子半径大小顺序为Mg>Al>N>O>H。
(2)X和Y分别的是H2O和H2O2,由于H2O2可以分解生成氧气,所以区别的方法是加入MnO2放出气体的是双氧水。电子数相等的分别是氨气和N2H4,氨气是三角锥形,N2H4的结构式是
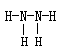 。
。(3)非金属性强的元素能置换出非金属性弱的,即
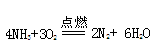 。
。(4)由于单质铝能和氢氧化钠溶液反应,所以可以原电池,铝是负极,所以电极反应式为Al-3e+4OH-=AlO2-+2H2O。

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案
相关题目


 物;D与B可形成离子化合物,其晶胞结构如右图所示。请回答下列问题。
物;D与B可形成离子化合物,其晶胞结构如右图所示。请回答下列问题。
