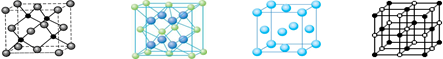
题目内容
(12分)下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区的元素是 (填编号)。写出 号元素的核外电子排布式_______________________________________;
号元素的核外电子排布式_______________________________________; 第一电离能的大小关系为________________(用元素符号表示)
第一电离能的大小关系为________________(用元素符号表示)
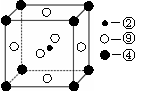
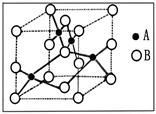
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为 (用对应的元素符号表示)。
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是 。
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的价电子数为 ; 该元素与元素①形成的分子X在①与③形成的分子Y中的溶解度很大,其主要原因是 。

请回答下列问题:
(1)表中属于d区的元素是 (填编号)。写出
 号元素的核外电子排布式_______________________________________;
号元素的核外电子排布式_______________________________________;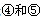 第一电离能的大小关系为________________(用元素符号表示)
第一电离能的大小关系为________________(用元素符号表示)(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为 (用对应的元素符号表示)。

(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是 。
| A.分子中含有氢键 | B.易发生加成反应 |
| C.含有4个σ键和1个π键 | D.分子中所有原子处于同一个平面 |
(12分) (1)⑨ (1分) 1s22s22p63s23p6 3d104s1
(2分) Mg>Al (2分) (2)MgCNi3或CMgNi3 (2分) (3)B D (2分)
(4)5(1分); X和Y都是极性分子(且能形成氢键),根据相似相溶原理,极性分子易溶于极性溶剂中。(2分)
(2分) Mg>Al (2分) (2)MgCNi3或CMgNi3 (2分) (3)B D (2分)
(4)5(1分); X和Y都是极性分子(且能形成氢键),根据相似相溶原理,极性分子易溶于极性溶剂中。(2分)
试题分析:(1)区的名称来自于按照构造原理最后填入电子的轨道名称,所以根据元素周期表的结构可知,表中属于d区的元素是⑨;⑩是铜,根据构造原理可知,核外电子排布是1s22s22p63s23p6 3d104s1;金属性越强,第一电离能越小。但由于Mg的3s轨道电子处于全充满状态,稳定性好,所以第一电离能是Mg>Al。
(2)②是碳元素,位于体心处,含有1个碳原子;④是镁位于顶点处,含有
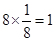 个镁原子;⑨是Ni,含有
个镁原子;⑨是Ni,含有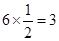 个Ni原子,所以化学式是MgCNi3或CMgNi3。
个Ni原子,所以化学式是MgCNi3或CMgNi3。(3)乙烯的产量作为衡量石油化工发展水平的标志,所以该化合物是乙烯。乙烯分子中含有碳碳双键,属于平面型结构,能发生加成反应,BD正确;由于双键都是由1个α键和1个π键构成的,所以乙烯分子含有6个σ键和1个π键,乙烯分子中不含有氢键,A和C不正确,答案选BD。
(4)由于s能级只能容纳2个电子,则n=2。所以根据元素的特征电子排布式为nsnnpn+1可知,该元素原子的价电子数为5个,该元素是氮元素。氨气和水都是极性分子(且能形成氢键),根据相似相溶原理,极性分子易溶于极性溶剂中。
点评:该题是高考中的常见题型,属于中等难度的试题。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案
相关题目
 )。
)。