题目内容
【题目】电化学在我们的生产生活中占有越来越重要的地位。
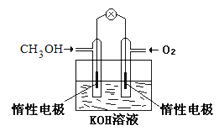
(1)①燃料电池是一种绿色环保、高效的化学电源。上图为甲醇燃料电池,则负极反应式为____。
②用甲醇燃料电池电解300mL饱和食盐水,则电解的化学方程式为_________。电解一段时间后,当溶液的pH值为13时,消耗O2的质量为______g。(忽略溶液体积变化,不考虑损耗)
③用甲醇燃料电池电解2L,1mol/L硫酸铜溶液,一段时间后:两极共收集到标准状况下的气体89.6L,则电路中共转移_______mol电子。
(2)利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来处理含Cr2O72-废水,如下图所示;电解过程中溶液发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
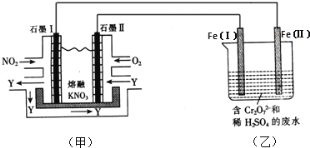
①甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5,可循环使用,则石墨Ⅱ附近发生的电极反应式为__。
②向完全还原为Cr3+的乙池工业废水中滴加NaOH溶液,可将铬以Cr(OH)3沉淀的形式除去,已知Cr(OH)3存在以下溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的溶度积Ksp=c(Cr3+)c3(OH-)=1.0×10-32,要使c(Cr3+)降至10-5molL-1,溶液的pH应调至________。
Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的溶度积Ksp=c(Cr3+)c3(OH-)=1.0×10-32,要使c(Cr3+)降至10-5molL-1,溶液的pH应调至________。
【答案】CH3OH-6e-+8OH-=CO32-+6H2O 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ 0.24g 8 O2+4e-+2N2O5=4NO3- 5
2NaOH+H2↑+Cl2↑ 0.24g 8 O2+4e-+2N2O5=4NO3- 5
【解析】
(1) ①以KOH溶液作电解质溶液,甲醇燃料电池总反应式为2CH3OH+3O2+4OH-=2CO32-+6H2O,分析反应中元素化合价变化可确定CH3OH通入的一极为负极,据此写电极反应式。
②甲醇燃料电池总反应式2CH3OH+3O2+4OH-=2CO32-+6H2O,电解饱和食盐水总反应式:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,分析两个反应中的电子转移数目,结合甲醇燃料电池与电解池电子得失守恒找出关系式解答。
2NaOH+H2↑+Cl2↑,分析两个反应中的电子转移数目,结合甲醇燃料电池与电解池电子得失守恒找出关系式解答。
③根据电解硫酸铜的反应式2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4可确定一定量CuSO4电解产生的气体物质的量,可判断CuSO4电解完全后还有部分水被电解,以此分析解答。
2Cu+O2↑+2H2SO4可确定一定量CuSO4电解产生的气体物质的量,可判断CuSO4电解完全后还有部分水被电解,以此分析解答。
(2) ①根据图示NO2转化为N2O5,由氮元素化合价的变化确定石墨I为负极,电解质为熔融KNO3,通入O2和N2O5一极转化为NO3-,确定石墨II为正极,再写电极反应式。
②Cr(OH)3沉淀完全时溶液中离子浓度有溶度积关系:c(Cr3+)·c3(OH-)=Ksp,再结合水的离子积常数计算溶液中pH。
(1) ①图示为甲醇燃料电池,电解质溶液为KOH溶液,电池总反应为2CH3OH+3O2+4OH-=2CO32-+6H2O,CH3OH中碳元素化合价由-2价升高到CO32-中的+4价,失去电子,所以通入CH3OH的一极为负极,负极反应式为CH3OH-6e-+8OH-=CO32-+6H2O。
②电解饱和食盐水时生成NaOH和Cl2、H2,其化学方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。电解一段时间后溶液中的c(H+)=10-13mol/L,则电解生成NaOH的物质的量浓度c(NaOH)=c(OH-)=
2NaOH+H2↑+Cl2↑。电解一段时间后溶液中的c(H+)=10-13mol/L,则电解生成NaOH的物质的量浓度c(NaOH)=c(OH-)=![]() =
=![]() =0.1mol/L,即生成NaOH的物质的量n(NaOH)=0.3L×0.1mol/L=0.03mol,根据甲醇燃料电池与电解池电子得失守恒有:CH3OH~
=0.1mol/L,即生成NaOH的物质的量n(NaOH)=0.3L×0.1mol/L=0.03mol,根据甲醇燃料电池与电解池电子得失守恒有:CH3OH~![]() O2~6e-~6NaOH,则消耗O2质量m(O2)=
O2~6e-~6NaOH,则消耗O2质量m(O2)=![]() ·n(NaOH)·M(O2)=
·n(NaOH)·M(O2)=![]() ×0.03mol×32g/mol=0.24g。
×0.03mol×32g/mol=0.24g。
③2L溶液中硫酸铜物质的量n(CuSO4)=2L×1mol/L=2mol,两极共收集气体物质的量=![]() =4mol,根据电解反应方程式2CuSO4+2H2O
=4mol,根据电解反应方程式2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4知2molCuSO4完全电解只能生成1molO2(小于4mol);说明后来电解水:2H2O
2Cu+O2↑+2H2SO4知2molCuSO4完全电解只能生成1molO2(小于4mol);说明后来电解水:2H2O![]() 2H2↑+O2↑,电解水生成的气体物质的量为4mol-1mol=3mol。分析两步电解方程式可知:电解2molCuSO4转移4mole-,电解水时生成3mol气体转移4mole-,所以电路中共转移电子物质的量=4mole-+4mole-=8mole-,即8mol电子。
2H2↑+O2↑,电解水生成的气体物质的量为4mol-1mol=3mol。分析两步电解方程式可知:电解2molCuSO4转移4mole-,电解水时生成3mol气体转移4mole-,所以电路中共转移电子物质的量=4mole-+4mole-=8mole-,即8mol电子。
(2) ①甲池为NO2、O2和熔融KNO3组成的燃料电池,由图示知电池工作时通入NO2的一极产生N2O5,氮元素的化合价由+4价升高到+5价,失去电子,故石墨I作负极,所以石墨II作正极;且电解质是熔融KNO3,所以通入O2和N2O5转化为NO3-,则石墨Ⅱ附近发生的电极反应为O2+4e-+2N2O5=4NO3-。
②要使c(Cr3+)降至10-5molL-1,则此时溶液中c(OH-)=![]() =
=![]() =10-9mol/L,c(H+)=
=10-9mol/L,c(H+)=![]() =
=![]() =10-5mol/L,pH=-lg10-5=5,即溶液的pH应调至5。
=10-5mol/L,pH=-lg10-5=5,即溶液的pH应调至5。

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案