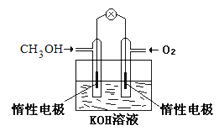
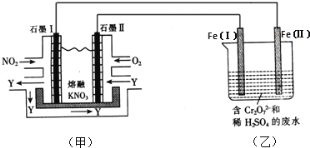
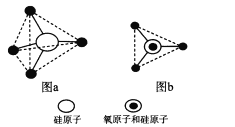
题目内容
【题目】稀氨水中存在着下列平衡:NH3·H2O![]() NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是
①NH4Cl固体;②硫酸;③NaOH固体;④水;⑤加热;⑥加入少量MgSO4固体。
A. ①②③⑤ B. ③⑥ C. ③ D. ③⑤
【答案】C
【解析】
试题①若在氨水中加入NH4Cl固体,c(NH4+)增大,平衡向逆反应方向移动,c(OH-)减小,不合题意,错误;②硫酸电离产生的H+与溶液中的OH-反应,使c(OH-)减小,平衡向正反应方向移动,不合题意,错误;③当向氨水中加入NaOH固体后,c(OH-)增大,平衡向逆反应方向移动,符合题意,正确;④若在氨水中加入水,稀释溶液,平衡向正反应方向移动,使c(OH-)减小,不合题意,错误;⑤电离属吸热过程,加热使电离平衡向正反应方向移动,c(OH-)增大,错误;⑥加入MgSO4固体,盐电离产生的Mg2+与溶液中的OH-发生反应Mg2++2OH-===Mg(OH)2↓,使溶液中c(OH)-减小,错误。故符合要求的只有③,选项C正确。

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目