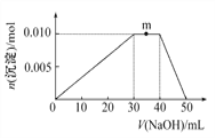
题目内容
【题目】A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:A _______ ,B________,C________,D________,E__________
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:____________ 。
(3)写出A、B两元素最高价氧化物的水化物相互反应的化学方程式:______________ 。
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)_______________ 。
【答案】Na Al Si P Cl 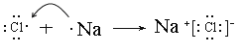 Al(OH)3+NaOH=NaAlO2+2H2O H3PO4>H2SiO3
Al(OH)3+NaOH=NaAlO2+2H2O H3PO4>H2SiO3
【解析】
由“这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水”可知,在A、B、E 中必定有Al,由“A、B、C、D、E为原子序数依次增大的短周期元素”和“C元素的最外层电子数比次外层电子数少4”可知,C为Si,又由“D元素原子次外层电子数比最外层电子数多3”,所以D为P,所以只能B为Al,A为Na;E可能为Cl或S,当E为S时,不满足“A、B、E 3种原子最外层共有11个电子”,所以E只能为Cl,根据题目要求和元素性质和元素周期律知识来解答。
由“这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水”可知,在A、B、E 中必定有Al,由“A、B、C、D、E为原子序数依次增大的短周期元素”和“C元素的最外层电子数比次外层电子数少4”可知,C为Si,又由“D元素原子次外层电子数比最外层电子数多3”,所以D为P,所以只能B为Al,A为Na;E可能为Cl或S,当E为S时,不满足“A、B、E 3种原子最外层共有11个电子”,所以E只能为Cl。
(1)由以上分析可知A为Na,B为Al,C为Si,D为P,E为Cl;
答案:Na;Al;Si;P;Cl;
(2)A与E两元素可形成化合物为NaCl,用电子式表示其化合物的形成过程为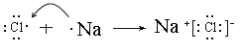 ;
;
答案: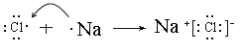
(3)A、B两元素最高价氧化物的水化物分别为NaOH和Al(OH)3,相互反应的化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O;
答案:Al(OH)3+NaOH=NaAlO2+2H2O
(4)C为Si,D为P,非金属性P>Si,元素的非金属性越强,最高价氧化物水化物酸性越强,因此H3PO4>H2SiO3;
答案:H3PO4>H2SiO3

 名校课堂系列答案
名校课堂系列答案【题目】化学反应的快慢和限度对人类生产生活有重要的意义。
(1)将影响反应速率条件填在空格处。
实 例 | 影响条件 |
① 食物放在冰箱里能延长保质期 | ①__________ |
② 实验室将块状药品研细,再进行反应 | ②__________ |
③ 用H2O2分解制O2时,加入MnO2 | ③__________ |
④ 实验室制备H2时,用较浓的硫酸与Zn粒反应 | ④__________ |
(2)如图所示,800℃时A、B、C三种气体在密闭容器中反应时的浓度变化,分析图像,回答问题:
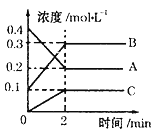
①该反应生成物是_______________。
②2min内,C的反应速率为____________________。
③该反应的方程式为__________________________。
④在其他条件下,测得A的反应速率为0.05mol/(L·s),此时的反应与800℃时相比,______________。
A.比800℃时慢 B.比800℃时快 C.和800℃时速率一样