题目内容
【题目】天然气可以制备大量的化工原料。请回答下列问题:
(1)由天然气制备合成气(CO和H2),进而可合成H2C2O4。
①欲加快H2C2O4溶液使5mL0.01mol/L酸性KMnO4溶液褪色,可采取的措施有__________、_______________(写两点)。
②下列可以证明H2C2O4是弱酸的是___________。
A.H2C2O4可以分解为CO、CO2和H2O
B.常温下,0.1mol/LNaHC2O4溶液中c(HC2O4-)+c(C2O42-)<0.lmol/L
C.0.1mol/LH2C2O4溶液25mL可以消耗0.1mol/LNaOH溶液50mL
D.常温下,0.05mol/L的H2C2O4溶液pH≈4
(2)已知:①CO(g)+H2(g)![]() C(s)+H2O(g) △H1=-130kJ/mol
C(s)+H2O(g) △H1=-130kJ/mol
②CH4(g)![]() C(s)+2H2(g) △H2=+76kJ/mol
C(s)+2H2(g) △H2=+76kJ/mol
③CO2(g)+H2(g)![]() CO(g)+H20(g) △H3=+41kJ/mol
CO(g)+H20(g) △H3=+41kJ/mol
则CH4(g)+CO2(g)![]() 2H2(g)+2CO(g) △H=________。
2H2(g)+2CO(g) △H=________。
(3)向2L容器中通入3molCO2、3molCH4,在不同温度下,以镍合金为催化剂,发生反应:CH4(g)+CO2(g)![]() 2H2(g)+2CO(g)。平衡体系中CH4和CO2的体积分数如下图。
2H2(g)+2CO(g)。平衡体系中CH4和CO2的体积分数如下图。
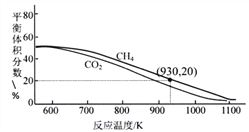
①高温下该反应能自发进行的原因是______________,930K时的平衡常数K=___________(保留两位小数)。
②请解释图中曲线随温度变化的原因______________。
③在700~1100K内,同温度下平衡转化率:CO2________CH4(填“大于”、“ 小于”或“等于”),结合(2)提供的反应分析,其原因可能是______________。
【答案】 升温 增大H2C2O4浓度、加Mn2+催化剂(任两点) BD +247kJ/mol △S>0 3.72moL2/L2 正反应吸热,升温平衡向正反应方向移动,反应物体积分数减小 大于 CO2+H2=CO+H2O副反应的量多于CH4 =C+2H2
【解析】(1)①升高温度,增大H2C2O4浓度都可以使反应速率加快;正确答案:增大H2C2O4浓度、加Mn2+催化剂(任两点)。
②H2C2O4可以分解为CO、CO2和H2O,只能证明H2C2O4不稳定,易发生分解;A错误;
NaHC2O4中HC2O-4 ![]() H++ C2O42-, HC2O4-+H2O
H++ C2O42-, HC2O4-+H2O![]() H2C2O4+OH-,根据物料守恒:c(HC2O4-)+c(C2O42-)+ c(H2C2O4)=c(Na+),所以0.1mol/LNaHC2O4溶液中c(HC2O4-)+c(C2O42-)<0.lmol/L,所以H2C2O4是弱酸,B正确;0.1mol/LH2C2O4溶液25mL可以消耗0.1mol/LNaOH溶液50mL恰好完全中和,不能证明H2C2O4是弱酸,C错误;常温下,如果0.05mol/L的H2C2O4溶液为强酸,c(H=)=0.1mol/L,pH=1,而实际pH≈4,H2C2O4是弱酸,D正确;正确选项BD。
H2C2O4+OH-,根据物料守恒:c(HC2O4-)+c(C2O42-)+ c(H2C2O4)=c(Na+),所以0.1mol/LNaHC2O4溶液中c(HC2O4-)+c(C2O42-)<0.lmol/L,所以H2C2O4是弱酸,B正确;0.1mol/LH2C2O4溶液25mL可以消耗0.1mol/LNaOH溶液50mL恰好完全中和,不能证明H2C2O4是弱酸,C错误;常温下,如果0.05mol/L的H2C2O4溶液为强酸,c(H=)=0.1mol/L,pH=1,而实际pH≈4,H2C2O4是弱酸,D正确;正确选项BD。
(2)根据盖斯定律可知:②-①+③,可得CH4(g)+CO2(g)![]() 2H2(g)+2CO(g) △H=+247kJ/mol; 正确答案:CH4(g)+CO2(g)
2H2(g)+2CO(g) △H=+247kJ/mol; 正确答案:CH4(g)+CO2(g)![]() 2H2(g)+2CO(g) △H=+247kJ/mol。
2H2(g)+2CO(g) △H=+247kJ/mol。
(3)①从图像可知,温度升高,平衡体系中CH4和CO2的体积分数,正反应为吸热反应,△H>0,△S>0,高温下该反应能自发进行;
设甲烷的变化量为x mol,容器的体积为2L;
根据反应:CH4(g)+CO2(g)![]() 2H2(g)+2CO(g)
2H2(g)+2CO(g)
起始量 3 3 0 0
变化量 x x 2x 2x
平衡量 3-x 3-x 2x 2x
平衡体系中CH4的体积分数为20%,则(3-x)/ (3-x+3-x+2x+2x)=20%, x=9/7mol; 各物质浓度:c(CH4 )=6/7mol/L ;c(CO2)= 6/7mol/L;c(H2)=9/7mol/L; c( CO)= 9/7mol/L;c2(H2)×c2( CO)=(9/7)2×(9/7)2=(81/49)2,c(CH4 )×c(CO2)=6/7×6/7=36/42,930K时的平衡常数K=c2(H2)×c2( CO)/ c(CH4 )×c(CO2)= (81/49)2/36/42=3.72moL2/L2;正确答案:△S>0 ;3.72moL2/L2 。
②根据图像变化可知,升高温度,反应物体积分数减小,平衡右移,正反应为吸热反应;正确答案:正反应吸热,升温平衡向正反应方向移动,反应物体积分数减小。
③在700~1100K内,同温度下,二氧化碳体积分数小于甲烷的体积分数,说明二氧化碳消耗的多,平衡转化率大于甲烷;其原因可能是CO2+H2=CO+H2O副反应的量多于CH4 =C+2H2;正确答案:大于;CO2+H2=CO+H2O副反应的量多于CH4 =C+2H2。