题目内容
【题目】某同学为了探究沉淀的溶解平衡原理并测定某温度下PbI2的溶度积常数,设计了如下实验:I、取100mL蒸馏水,加入过量的PbI2固体(黄色),搅拌、静置,过滤到洁净的烧杯中,得到滤液a ;II、取少量滤液a于试管中,向其中加入几滴0.1mol/L的KI溶液,观察现象 ; III、另准确量取10.00 mL滤液,与离子交换树脂(RH)发生反应:2RH+Pb2+=R2Pb+2H+,交换完成后,流出液用中和滴定法测得n (H+)=3.000×10—5mol。分析过程,下列说法错误的是
A.步骤I中搅拌的目的是使碘化铅充分溶解
B.步骤II中观察到的现象是产生黄色沉淀
C.此实验温度下,PbI2的溶度积常数Ksp=1.350×10-8
D.若步骤I 盛装滤液的烧杯中有少量的水,Ksp的测定结果不受影响
【答案】D
【解析】
A.步骤I中搅拌的目的是使为了加速固体碘化铅的溶解速率,使物质充分溶解,选项A正确;
B.根据步骤I可知滤液是碘化铅的饱和溶液。在溶液中存在沉淀溶解平衡:PbI2(s)![]() Pb2+(aq) +2I-(aq)。当向该溶液中加入几滴0.1mol/L的KI溶液时,c(I-)增大,c(Pb2+)c2(I-)>Ksp[PbI2(s)],沉淀溶解平衡向逆向移动,所以在步骤II中会观察到产生黄色沉淀,选项B正确;
Pb2+(aq) +2I-(aq)。当向该溶液中加入几滴0.1mol/L的KI溶液时,c(I-)增大,c(Pb2+)c2(I-)>Ksp[PbI2(s)],沉淀溶解平衡向逆向移动,所以在步骤II中会观察到产生黄色沉淀,选项B正确;
C.根据步骤III中反应方程式2RH+Pb2+=R2Pb+2H+,可知n(Pb2+)=" n" (H+)/2=1.500×10—5mol。则n(I-)=2 n(Pb2+)=3.000×10—5mol。c(Pb2+)=1.500×10—5mol÷0.0100 L=1.500×10—3mol/L;c(I-)=![]() =3.000×10—3mol/L。所以此实验温度下,PbI2的溶度积常数Ksp=c(Pb2+)c2(I-)=1.500×10—3mol/L×(3.000×10—3mol/L)=1.350×10-8 mol3/L3,选项C正确;
=3.000×10—3mol/L。所以此实验温度下,PbI2的溶度积常数Ksp=c(Pb2+)c2(I-)=1.500×10—3mol/L×(3.000×10—3mol/L)=1.350×10-8 mol3/L3,选项C正确;
D.沉淀溶解平衡常数只与温度有关,而与其它外界条件无关。所以若步骤I 盛装滤液的烧杯中有少量的水,使c(Pb2+)、c(I-)>减小,所以Ksp的测定结果就必然偏小,选项D错误。
答案选D。

【题目】温度为T℃时,向V L的密闭容器中充入一定量的A和B,发生的反应为A(g)+B(g)![]() C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如表所示。下列说法不正确的是( )
C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如表所示。下列说法不正确的是( )
时间 | 0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min |
A的物质的量浓度(mol·L-1) | 3.5 | 2.3 | 2.0 | 2.0 | 2.8 | 3.0 | 3.0 |
B的物质的量浓度(mol·L-1) | 2.5 | 1.3 | 1.0 | 1.0 | 1.8 | 2.0 | 2.0 |
D的物质的量浓度(mol·L-1) | 0 | 2.4 | 3.0 | 3.0 | 1.4 | 1.0 | 1.0 |
A.前10 min的平均反应速率v(D)=0.3 mol·L-1·min-1
B.该反应的平衡常数表达式为K=![]()
C.若达到平衡时保持温度不变,压缩容器体积,平衡不移动
D.反应至15 min时,改变的条件可以是降低温度
【题目】(2018·安徽省合肥市高三第三次教学质量检测)H2S在重金属离子处理、煤化工等领域都有重要应用。请回答:
Ⅰ.H2S是煤化工原料气脱硫过程的重要中间体,反应原理为
ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g)△H=+7kJ·mol1
H2S(g)+CO(g)△H=+7kJ·mol1
ⅱ.CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=42kJ·mol1
CO2(g)+H2(g)△H=42kJ·mol1
已知断裂1mol气态分子中的化学键所需能量如下表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) |
能量(kJ·mol1) | 1310 | 442 | x | 669 |
(1)计算表中x=_______。
(2)T℃时,向VL容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),发生上述两个反应。
①在T℃时测得平衡体系中COS为0.80 mol,H2为0.85 mol,则T℃时反应ⅰ的平衡常数K=_______(保留2位有效数字)。
②上述反应达平衡后,若向其中再充入1mol COS(g)、1molH2(g)和1mol H2O(g),则再次达平衡后H2的体积分数_______(填“增大”、“减小”或“不变”);若升高温度,则CO的平衡体积分数_______(填“增大”、“减小”或“不变”),其理由是_______。
Ⅱ.H2S在高温下分解制取H2,同时生成硫蒸气。
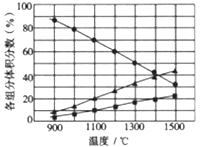
(3)向2L密闭容器中加入0.2molH2S,反应在不同温度(900~1500℃)下达到平衡时,混合气体中各组分的体积分数如下图所示,则在此温度区间内,H2S分解反应的主要化学方程式为_______;在1300℃时,反应经2min达到平衡,则0~2min的反应速率v(H2S)=_______。
Ⅲ.H2S用作重金属离子的沉淀剂。
(4)25℃时,向浓度均为0.001mol·L1Sn2+和Ag+的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Ag+)=_______。(已知:25℃时,Ksp(SnS)=1.0×1025,Ksp(Ag2S)=1.6×1049)。


