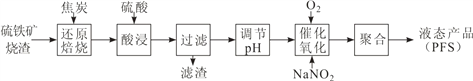
题目内容
【题目】(2018·安徽省合肥市高三第三次教学质量检测)H2S在重金属离子处理、煤化工等领域都有重要应用。请回答:
Ⅰ.H2S是煤化工原料气脱硫过程的重要中间体,反应原理为
ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g)△H=+7kJ·mol1
H2S(g)+CO(g)△H=+7kJ·mol1
ⅱ.CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=42kJ·mol1
CO2(g)+H2(g)△H=42kJ·mol1
已知断裂1mol气态分子中的化学键所需能量如下表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) |
能量(kJ·mol1) | 1310 | 442 | x | 669 |
(1)计算表中x=_______。
(2)T℃时,向VL容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),发生上述两个反应。
①在T℃时测得平衡体系中COS为0.80 mol,H2为0.85 mol,则T℃时反应ⅰ的平衡常数K=_______(保留2位有效数字)。
②上述反应达平衡后,若向其中再充入1mol COS(g)、1molH2(g)和1mol H2O(g),则再次达平衡后H2的体积分数_______(填“增大”、“减小”或“不变”);若升高温度,则CO的平衡体积分数_______(填“增大”、“减小”或“不变”),其理由是_______。
Ⅱ.H2S在高温下分解制取H2,同时生成硫蒸气。
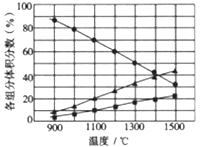
(3)向2L密闭容器中加入0.2molH2S,反应在不同温度(900~1500℃)下达到平衡时,混合气体中各组分的体积分数如下图所示,则在此温度区间内,H2S分解反应的主要化学方程式为_______;在1300℃时,反应经2min达到平衡,则0~2min的反应速率v(H2S)=_______。
Ⅲ.H2S用作重金属离子的沉淀剂。
(4)25℃时,向浓度均为0.001mol·L1Sn2+和Ag+的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Ag+)=_______。(已知:25℃时,Ksp(SnS)=1.0×1025,Ksp(Ag2S)=1.6×1049)。
【答案】 1076 0.044 不变 增大 反应ⅰ为吸热反应,升高温度,平衡正向移动,CO的平衡体积分数增大;反应ⅱ为放热反应,升高温度,平衡逆向移动,CO的平衡体积分数也增大 2H2S![]() 2H2+S2 0.02mol·L1·min1 4.0×1014mol·L1
2H2+S2 0.02mol·L1·min1 4.0×1014mol·L1
【解析】Ⅰ.试题分析:H2S是煤化工原料气脱硫过程的重要中间体,反应原理为ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g)△H=+7kJ·mol-1,该反应为吸热反应 ;ⅱ.CO(g)+H2O(g)
H2S(g)+CO(g)△H=+7kJ·mol-1,该反应为吸热反应 ;ⅱ.CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=-42kJ·mol-1,该反应为放热反应。
CO2(g)+H2(g)△H=-42kJ·mol-1,该反应为放热反应。
(1)化学反应的反应热等于反应物的键能总和减去生成物的键能总和。由COS(g)+H2(g)![]() H2S(g)+CO(g) △H=+7kJ·mol-1可知,1310+442-x-669=7,所以x=1076。
H2S(g)+CO(g) △H=+7kJ·mol-1可知,1310+442-x-669=7,所以x=1076。
(2)T℃时,向VL容积不变的密闭容器中充入1molCOS(g)、1molH2(g)和1molH2O(g),发生上述两个反应。
①在T℃时测得平衡体系中COS为0.80mol,H2为0.85mol,由物料守恒可以求出H2S和CO 的平衡量分别为0.20mol和0.15mol,由于反应ⅰ中各组分的化学计量数均为1,所以,T℃时反应ⅰ的平衡常数K=![]() 。
。
②上述反应达平衡后,若向其中再充入1molCOS(g)、1molH2(g)和1molH2O(g),则与原平衡体系的起始投料的配比相同,由于两个反应均分气体分子数不变的反应,所以再次达平衡后H2的体积分数不变;若升高温度,则CO的平衡体积分数增大,因为反应ⅰ为吸热反应,升高温度,平衡正向移动,CO的平衡体积分数增大;而反应ⅱ为放热反应,升高温度,平衡逆向移动也使CO的平衡体积分数也增大。
Ⅱ.H2S在高温下分解制取H2,同时生成硫蒸气。
(3)向2L密闭容器中加入0.2molH2S,反应在不同温度(900~1500℃)下达到平衡时,由图中数据可知,混合气体中两种生成物的体积分数不同,其中一种生成物的体积分数约是另一种的2倍,由此可以推断,H2S主要分解为H2和S2,则在此温度区间内,H2S分解反应的主要化学方程式为2H2S![]() 2H2+S2;在1300℃时,反应经2min达到平衡,由图中数据可知,此时的体积分数为50%,设H2S的变化量为x,则H2和S2的变化量分别为x和0.5x,则
2H2+S2;在1300℃时,反应经2min达到平衡,由图中数据可知,此时的体积分数为50%,设H2S的变化量为x,则H2和S2的变化量分别为x和0.5x,则![]() ,解之得x=0.08mol,所以,0~2min的反应速率v(H2S)=
,解之得x=0.08mol,所以,0~2min的反应速率v(H2S)= ![]() 0.02mol·L-1·min-1。
0.02mol·L-1·min-1。
Ⅲ.H2S用作重金属离子的沉淀剂。
(4)25℃时,向浓度均为0.001mol·L-1Sn2+和Ag+的混合溶液中通入H2S,当Sn2+开始沉淀时,c(S2-)![]() mol/L,所以,溶液中c(Ag+)=
mol/L,所以,溶液中c(Ag+)=![]() 4.0×10-14mol·L-1。
4.0×10-14mol·L-1。