题目内容
【题目】用惰性电极电解一定浓度的 CuSO4 溶液一段时间后,欲使溶液恰好恢复至电解前情况,需加入的物质是
A. CuSO4 B. Cu C. CuCO3 D. Cu2O
【答案】C
【解析】
CuSO4溶液存在的阴离子为:SO42-、OH-,放电能力:OH->SO42- ,OH-离子放电生成氧气;溶液中存在的阳离子是Cu2+、H+,放电能力:Cu2+>H+,所以Cu2+离子放电生成Cu,溶液变成硫酸溶液;电解硫酸铜溶液的方程式为:2CuSO4+2H2O![]() 2Cu+O2 ↑+2H2SO4,
2Cu+O2 ↑+2H2SO4,
从溶液中析出的物质是氧气和铜,根据元素守恒可知,向溶液中加入氧化铜可恢复至电解前情况,CuCO3与硫酸发生反应,产生的CO2气体从溶液中逸出。或者这样理解:CuCO3比CuO多CO2的组成,CuCO3与硫酸发生反应时,CO2会从溶液中逸出,所以进入溶液的成分与CuO相同,因此也可向该溶液中加入CuCO3 使溶液复原,故合理选项是C。

【题目】下面a~e是中学化学实验中常见的几种定量仪器:a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
(1)无“0”刻度的是________(填字母)。
(2)下列操作合理的是________(填字母)。
A.用25 mL碱式滴定管量取20.00 mL NaHCO3溶液
B.用托盘天平准确称量10.20 g碳酸钠固体
C.用100 mL量筒量取3.2 mL浓硫酸
D.用500 mL容量瓶配制1 mol·L-1的氢氧化钠溶液495.5 mL
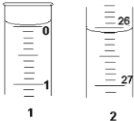
(3)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,若滴定开始和结束时,酸式滴定管中的液面如图所示:则所用盐酸的体积为________mL。
(4)某学生根据三次实验分别记录有关数据如下表:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积 | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
请选用其中合理数据列出该氢氧化钠溶液物质的量浓度(计算结果保留4位有效数字):c(NaOH)=________ mol·L-1。
(5)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是________(填字母)。
A.中和滴定达终点时俯视滴定管内液面读数
B.碱式滴定管用蒸馏水洗净后立即取用25.00 mL待测碱溶液注入锥形瓶进行滴定
C.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.把配好的标准溶液倒入刚用蒸馏水洗净的试剂瓶中然后用来滴定