题目内容
【题目】温度为T℃时,向V L的密闭容器中充入一定量的A和B,发生的反应为A(g)+B(g)![]() C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如表所示。下列说法不正确的是( )
C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如表所示。下列说法不正确的是( )
时间 | 0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min |
A的物质的量浓度(mol·L-1) | 3.5 | 2.3 | 2.0 | 2.0 | 2.8 | 3.0 | 3.0 |
B的物质的量浓度(mol·L-1) | 2.5 | 1.3 | 1.0 | 1.0 | 1.8 | 2.0 | 2.0 |
D的物质的量浓度(mol·L-1) | 0 | 2.4 | 3.0 | 3.0 | 1.4 | 1.0 | 1.0 |
A.前10 min的平均反应速率v(D)=0.3 mol·L-1·min-1
B.该反应的平衡常数表达式为K=![]()
C.若达到平衡时保持温度不变,压缩容器体积,平衡不移动
D.反应至15 min时,改变的条件可以是降低温度
【答案】B
【解析】A项中,0~10 min,D的物质的量浓度的变化量是3.0 mol·L-1,所以平均反应速度v(D)=3.0 mol·L-1÷10 min=0.3 mol·L-1·min-1,A正确;B项中,因为根据化学反应方程式知C为固体,所以平衡常数表达式中不应含有C物质,B不正确;C项中,根据表格中的数据知15 min时A、B的物质的量浓度均变化了1.5 mol·L-1,D的物质的量浓度变化了3.0 mol·L-1,A、D的物质的量浓度变化量之比为1∶2,所以x=2,该反应在反应前后气体分子数相等,改变容器体积对平衡没有影响, C正确;D项中,根据表格中的数据知15~20 min,A、B的物质的量浓度在增大,D的物质的量浓度在减少,平衡向逆反应方向移动,因为该反应是吸热反应,降低温度时平衡向逆反应方向移动,所以改变的条件可以是降低温度,D正确。

【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+ H2O(g)![]() CO2 (g)+ H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
CO2 (g)+ H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是( )
A. 反应在t1min内的平均速率为![]()
B. 保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时n(CO2)= 0.40mol
C. 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时H2O转化率增大
D. 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
【题目】下面a~e是中学化学实验中常见的几种定量仪器:a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
(1)无“0”刻度的是________(填字母)。
(2)下列操作合理的是________(填字母)。
A.用25 mL碱式滴定管量取20.00 mL NaHCO3溶液
B.用托盘天平准确称量10.20 g碳酸钠固体
C.用100 mL量筒量取3.2 mL浓硫酸
D.用500 mL容量瓶配制1 mol·L-1的氢氧化钠溶液495.5 mL
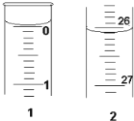
(3)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,若滴定开始和结束时,酸式滴定管中的液面如图所示:则所用盐酸的体积为________mL。
(4)某学生根据三次实验分别记录有关数据如下表:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积 | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
请选用其中合理数据列出该氢氧化钠溶液物质的量浓度(计算结果保留4位有效数字):c(NaOH)=________ mol·L-1。
(5)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是________(填字母)。
A.中和滴定达终点时俯视滴定管内液面读数
B.碱式滴定管用蒸馏水洗净后立即取用25.00 mL待测碱溶液注入锥形瓶进行滴定
C.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.把配好的标准溶液倒入刚用蒸馏水洗净的试剂瓶中然后用来滴定