��Ŀ����
����Ŀ��12.0gijҺ̬�л�������A��ȫȼ�պ�����14.4g H2O��26.4g CO2������л�������A��������H2������ܶ���30����
(1)�л���A�ķ���ʽ_______________________��(д���������)
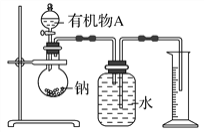
(2)����ͼ��ʾװ�òⶨ�л���A�ķ��ӽṹ��ʵ����������(ʵ�����ݾ��ѻ���Ϊ��״��)��a mL(�ܶ�Ϊ�� g/cm3)���л���A����������ȫ��Ӧ����ͲҺ�����Ϊb mL����1mol A��������x mol��ԭ���ܸ������Ʒ�Ӧ����x�ļ���ʽΪ____________(���Բ�����д���������)��
(3)��֪���л����ܹ�������ƻ�ط�����Ӧ�������л�����к˴Ź�����������ֺ˴Ź�������ͼ�����������շ壬�ҷ����֮��Ϊ6:1:1����д�������ʵĽṹ��ʽ��_________��
���𰸡�C3H8O ![]() ��
��![]()
![]()
��������
��1����n=![]() =
=![]() ����=
����=![]() ��֪����=
��֪����=![]() ������ͬ�������������Է�������֮�ȵ����ܶ�֮�ȣ��û����������������������ܶ�Ϊ30����û��������Է�������Ϊ30��2=60�������л��������������л�������ʵ�������������ˮ�Ͷ�����̼�����ʵ�����������غ�ɼ�������л���ķ���ʽΪC3H8O��
������ͬ�������������Է�������֮�ȵ����ܶ�֮�ȣ��û����������������������ܶ�Ϊ30����û��������Է�������Ϊ30��2=60�������л��������������л�������ʵ�������������ˮ�Ͷ�����̼�����ʵ�����������غ�ɼ�������л���ķ���ʽΪC3H8O��
��2�����ݷ�ӦΪC3H8O+xNa��C3H8-xONa+![]() H2��������xֵ��
H2��������xֵ��
��3�����л���Ϊ����������������뵥���ƻ�ط�Ӧ��˵�������ǻ����ٸ��ݺ˴Ź������������京��3�ֻ�ѧ��������ԭ�ӣ��ұ���Ϊ6:1:1���ɴ���д��ṹ��ʽ��
��1����n=![]() =
=![]() ����=
����=![]() ��֪����=
��֪����=![]() ������ͬ�������������Է�������֮�ȵ����ܶ�֮�ȣ��û����������������������ܶ�Ϊ30����û��������Է�������Ϊ30��2=60����n���л��=
������ͬ�������������Է�������֮�ȵ����ܶ�֮�ȣ��û����������������������ܶ�Ϊ30����û��������Է�������Ϊ30��2=60����n���л��=![]() =0.2mol��n��H2O��=
=0.2mol��n��H2O��=![]() =0.8mol��n��CO2��=
=0.8mol��n��CO2��=![]() =0.6mol��12g������m��C��=0.6mol��12g/mol=7.2g��m��H��=2��0.8mol��1g/mol=1.6g��m��O��=12.0g-7.2g-1.6g=3.2g��n��O��=
=0.6mol��12g�л����к���m��C��=0.6mol��12g/mol=7.2g��m��H��=2��0.8mol��1g/mol=1.6g��m��O��=12.0g-7.2g-1.6g=3.2g��n��O��=![]() =0.2mol�����Ը��л����к���N��C��==0.6mol/0.2mol=3��N(H)=1.6mol/0.2mol=8��N(O)=0.2mol/0.2mol=1�����л������ʽΪC3H8O��
=0.2mol�����Ը��л����к���N��C��==0.6mol/0.2mol=3��N(H)=1.6mol/0.2mol=8��N(O)=0.2mol/0.2mol=1�����л������ʽΪC3H8O��
��2��amL(�ܶ�Ϊ��g/cm3)���л���A������Ϊ��m=a��g��
���ʵ���Ϊ��![]() mol����ͲҺ�����ΪbmL�����������������ΪbmL����n(H2)=
mol����ͲҺ�����ΪbmL�����������������ΪbmL����n(H2)=![]() ��
��
��C3H8O+xNa��C3H8xONa+![]() H2��
H2��
1 ![]() mol
mol
![]()
![]()
��ã�x=![]() ��
��![]() ��
��
��3�����л���Ϊ����������������뵥���ƻ�ط�Ӧ��˵�������ǻ����˴Ź����������������շ壬��˵���京��3�ֻ�ѧ��������ԭ�ӣ��ұ���Ϊ6:1:1������仯ѧʽC3H8O����д�������ʵĽṹ��ʽΪ��![]() ��
��

����Ŀ�����������[(NH4)2Fe(SO4)2]�Ƿ�����ѧ�е���Ҫ�Լ����ڲ�ͬ�¶��¼��ȷֽ���ﲻͬ�������ͼʵ��װ�ã��г�װ����ȥ������500��ʱ������������A�е�������������ֽ���ȫ��ȷ���ֽ����ijɷ֡�

��1��Bװ�õ�������__________��
��2��ʵ���У��۲쵽C������������D���а�ɫ�������ɣ���ȷ�������ж���______���������д��D�з�����Ӧ�����ӷ���ʽ__________����ȥ��C���Ƿ��ܵó�ͬ�����۲�������ԭ��_____________��
��3��A�й�����ȫ�ֽ���Ϊ����ɫ��ĩ��ijͬѧ���ʵ����֤����������ΪFe2O3.������FeO������ɱ����ݡ�(�Լ�����Ȼ����Ʒ��ѡ)
ʵ�鲽�� | Ԥ������ | ���� |
ȡ����A�в��������Թ��У���������ϡ���ᣬ�����ʹ����ȫ�ܽ⣺_________ | ___________ | ����������ΪFe2O3 |
��4��E���ռ���������ֻ��N2�������ʵ���Ϊxmol����������������Ŀ��Fe2O3�����ʵ���Ϊymol��D�г������ʵ���Ϊzmol������������ԭ��Ӧ�Ļ������ɣ�x��y��zӦ����Ĺ�ϵΪ________��
��5���������ʵ�������������ݵķ�����д�������������500��ʱ��������������ȫ�ֽ�Ļ�ѧ����ʽ��_____________��