题目内容
2.相同条件下,下列各组中的两个反应的焓变前者大于后者的是( )| A. | H2(g)+Cl2(g)=2HCl(g) 和H2(g)+Cl2(g)=2HCl(aq) | |
| B. | C2H4(g)+H2(g)=C2H6(g)和C3H6(g)+H2(g)=C3H8(g) | |
| C. | 2H2(g)+O2(g)=2H2O(l)和2H2(g)+O2(g)=2H2O(g) | |
| D. | C(s)+O2(g)=CO2(g)和C(s)+12O2(g)=CO(g) |
分析 A、气态氯化氢变成液态氯化氢还要发热;
B、两个反应的本质都是断开“C=C“和“H-H”键(吸热),形成“C-H““C-C”(放热),据此分析;
C、液态水变成气态水要吸热;
D、碳不完全燃烧放热少;焓变包含负号比较大小.
解答 解:A、气态氯化氢变成液态氯化氢还要发热,所以生成液态氯化氢放出的热量多,又焓变为负值,所以生成气体氯化氢的焓变大,故A正确;
B、两个反应的本质都是断开“C=C“和“H-H”键(吸热),形成“C-H““C-C”(放热),断键成键基本一致 所以两反应放热几乎相等,故B错误;
C、液态水变成气态水要吸热,所以生成液态水放出的热量多,又焓变为负值,所以生成气体氯化氢的焓变大,故C错误;
D、碳不完全燃烧放热少,焓变包含负号比较大小,所以△H前者小于后者,故D错误;
故选:A.
点评 本题考查了物质反应能量变化分析判断,主要是物质的量不同、状态不同、产物不同等,放热反应中焓变包含负号比较大小.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
18.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2 L的戊烷所含的分子0.5NA | |
| B. | 28 g乙烯所含共用电子对数目为4NA | |
| C. | 标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为3 NA |
10.下列表示物质结构的化学用语或模型正确的是( )
| A. | 醛基的电子式 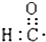 | B. | 丙烷的分子结构的比例模型: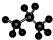 | ||
| C. | 乙烯的最简式(实验式):CH2 | D. | 硝基苯的结构简式: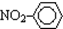 |
17.用a、b、c、d四种金属进行如下图所示的实验,部分反应现象如下表所示,由此判断四种金属的活动性由强到弱的顺序是( )
| 实验装置 | 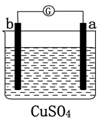 | 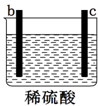 | 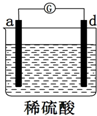 |
| 部分实验现象 | a极质量减少b极质量增加 | b极有气体产生c极无变化 | 电流从a极流向d极 |
| A. | abcd | B. | bcda | C. | dabc | D. | abdc |
14.下列关于钠元素的说法正确的是( )
| A. | 小苏打可以治疗胃酸过多,是利用了小苏打的酸性 | |
| B. | 与足量等浓度盐酸溶液反应的速率:NaHCO3<Na2CO3 | |
| C. | 久置在空气中的钠最后变成碳酸钠晶体 | |
| D. | 某未知样品灼烧时能使火焰呈黄色,说明该样品中肯定含有钠元素 |
11.有人将甲醇设计成为一种燃料电池,并用硫酸作电解质,其中发生的化学反应为:甲醇与氧气反应生成水和二氧化碳(aq表示溶液).该电池负极发生的反应是( )
| A. | CH3OH(g)+O2(g)-2e-=H2O(1)+CO2(g)+2H+(aq) | B. | O2(g)+4H+(aq)+4e-=2H2O(1) | ||
| C. | CH3OH(g)+H2O(1)-6e-=CO2(g)+6H+(aq) | D. | CH3OH(g)+8OH--6e-=CO32-( aq)+6H2O |
 A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等. .
. .
.