题目内容
2.对于A2+3B2=2C的反应来说,以下化学反应速率的表示中,反应速率最快的是( )| A. | V(B2)=0.8mol/(L•s) | B. | V(A2)=0.8mol/(L•s) | ||
| C. | V(C)=0.6mol/(L•s) | D. | V(A2)=1.8mol/(L•min) |
分析 比较四种不同情况下反应速率的快慢,由速率之比等于其化学计量数之比可知,反应速率与化学计量数的比值越大,反应速率越快,以此来解答.
解答 解:反应速率与化学计量数的比值越大,反应速率越快,则
A.$\frac{0.8}{3}$=0.26;
B.$\frac{0.8}{1}$=0.8;
C.$\frac{0.6}{2}$=0.3;
D.$\frac{\frac{1.8}{60}}{1}$=0.03,
显然B中比值最大,反应速率最快,
故选B.
点评 本题考查反应速率快慢的比较,为高频考点,把握比值法比较反应速率可快速解答该题,注意化学计量数与反应速率的关系,题目难度不大.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
13.创建和谐社会,保护生存环境是每一个公民的责任和义务.下列做法不符合人与自然和谐相处的是( )
| A. | 对废旧电池进行回收处理 | |
| B. | 购物时尽量不用塑料袋 | |
| C. | 对聚乙烯等塑料垃圾进行深埋或倾倒入海 | |
| D. | 使用沼气、太阳能、风能等能源替代传统的煤炭 |
17.在室温下,同规格的铝片分别与下列物质混合,化学反应速率最大的是( )
| A. | 18mol/L的浓硫酸15mL L | B. | 0.2mol/L的盐酸12mL | ||
| C. | 0.15mol/L的硫酸溶液8mL | D. | 0.1mol/L的盐酸15m |
7.下列各组有机物,只用水就可以鉴别出来的是( )
| A. | 己烷、己烯、己炔 | B. | 苯、己烯、乙醇 | C. | 溴苯、乙醇和甲苯 | D. | 硝基苯、苯和甲苯 |
14.向下列物质中加入金属钠和碳酸钠都能产生气体的物质是( )
| A. | H2O | B. | CH3COOC2H5 | C. | CH3CH2OH | D. | CH3COOH |
16.当光束分别通过下列分散系时,能观察到丁达尔效应的是( )
| A. | NaOH溶液 | B. | Fe(OH)3胶体 | C. | C2H5OH溶液 | D. | CuSO4溶液 |
17.某实验小组用工业上废渣(主要成分Cu2S和Fe2O3)制取纯铜和绿矾(FeSO4•7H2O)产品,设计流程如下:

(1)在实验室中,欲用98%的浓硫酸(密度为1.84g•mL-1)配制500mL1.0mol•L-1的硫酸,需要的仪器除量筒、烧杯、玻璃棒外,还有胶头滴管、500mL容量瓶.
(2)该小组同学设计如下装置模拟废渣在过量氧气中焙烧,并验证废渣中含硫元素.
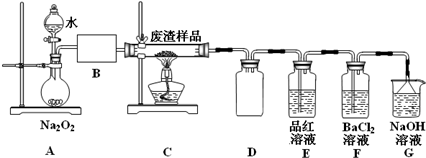
①装置A中反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑;为控制反应不过于激烈并产生平稳气流,采取的操作及现象是打开分液漏斗上口活塞,控制分液漏斗旋塞,使水匀速逐滴滴下;B处应连接盛有碱石灰的干燥管(或U形管)或浓硫酸的洗气瓶(填写试剂及仪器名称).
②E装置中加入品红溶液的目的是检验气体a中的SO2;当F装置中出现白色沉淀时,反应离子方程式为2SO2+O2+2H2O+2Ba2+=2BaSO4↓+4H+.
(3)下列操作中,不属于步骤⑤中进行的操作的是ad(填下列各项中序号).
步骤⑥中由粗铜得到纯铜的方法为电解精炼(填写名称).
(4)为测定产品中绿矾的质量分数,称取30.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol•L-1酸性KMnO4溶液进行滴定,反应为:10FeSO4+8H2SO4+2KMnO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O.实验所得数据如下表所示:
①第1组实验数据出现异常,造成这种异常的原因可能是ad(填代号).
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时俯视读数
d.滴定终点时仰视读数
②根据表中数据,计算所得产品中绿矾的质量分数为92.7%.

(1)在实验室中,欲用98%的浓硫酸(密度为1.84g•mL-1)配制500mL1.0mol•L-1的硫酸,需要的仪器除量筒、烧杯、玻璃棒外,还有胶头滴管、500mL容量瓶.
(2)该小组同学设计如下装置模拟废渣在过量氧气中焙烧,并验证废渣中含硫元素.

①装置A中反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑;为控制反应不过于激烈并产生平稳气流,采取的操作及现象是打开分液漏斗上口活塞,控制分液漏斗旋塞,使水匀速逐滴滴下;B处应连接盛有碱石灰的干燥管(或U形管)或浓硫酸的洗气瓶(填写试剂及仪器名称).
②E装置中加入品红溶液的目的是检验气体a中的SO2;当F装置中出现白色沉淀时,反应离子方程式为2SO2+O2+2H2O+2Ba2+=2BaSO4↓+4H+.
(3)下列操作中,不属于步骤⑤中进行的操作的是ad(填下列各项中序号).

步骤⑥中由粗铜得到纯铜的方法为电解精炼(填写名称).
(4)为测定产品中绿矾的质量分数,称取30.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol•L-1酸性KMnO4溶液进行滴定,反应为:10FeSO4+8H2SO4+2KMnO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O.实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.90 | 20.02 | 19.98 | 20.00 |
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时俯视读数
d.滴定终点时仰视读数
②根据表中数据,计算所得产品中绿矾的质量分数为92.7%.
 A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等. .
. .
. 已知H2O(g)=H2(g)+$\frac{1}{2}$O2(g),反应过程中能量变化如图所示.请回答下列问题:
已知H2O(g)=H2(g)+$\frac{1}{2}$O2(g),反应过程中能量变化如图所示.请回答下列问题: