题目内容
7.化学反应可视为旧键断裂和新键形成的过程.共价键的键能是两种原子间形成1mol共价键(或其可逆过程)时释放(或吸收)的能量.已知H-H 键的键能为436kJ•mol-1、Cl-Cl键的键能为243kJ•mol-1、H-Cl键的键能为X,若1molH2(g)与1mol Cl2(g)反应生成2mol HCl(g)放出 183kJ的热量,则X为( )| A. | 496 kJ•mol-1 | B. | 431 kJ•mol-1 | C. | 862 kJ•mol-1 | D. | 248 kJ•mol-1 |
分析 已知H-H 键的键能为436kJ•mol-1、Cl-Cl键的键能为243kJ•mol-1、H-Cl键的键能为X,若1molH2(g)与1mol Cl2(g)反应生成2mol HCl(g)放出 183kJ的热量,
根据反应热=反应物总键能-生成物总键能计算.
解答 解:已知H-H 键的键能为436kJ•mol-1、Cl-Cl键的键能为243kJ•mol-1、H-Cl键的键能为X,若1molH2(g)与1mol Cl2(g)反应生成2mol HCl(g)放出 183kJ的热量,
H2(g)+Cl2(g)═2HCl(g)△H=-183kJ/mol,
则△H=436kJ•mol-1+243kJ•mol-1-2×XkJ•mol-1=-183 kJ•mol-1,解得X=431 kJ•mol-1,
故选B.
点评 本题考查依据键能计算热化学方程式中焓变的方法,化学反应焓变=反应物键能总和-生成物总和,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
17.用a、b、c、d四种金属进行如下图所示的实验,部分反应现象如下表所示,由此判断四种金属的活动性由强到弱的顺序是( )
| 实验装置 | 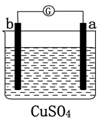 | 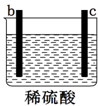 | 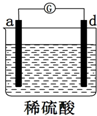 |
| 部分实验现象 | a极质量减少b极质量增加 | b极有气体产生c极无变化 | 电流从a极流向d极 |
| A. | abcd | B. | bcda | C. | dabc | D. | abdc |
15.下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是Ar,只有负化合价而无正价的元素是F,可用于制半导体材料的元素是Si.
(2)最高价氧化物的水化物中碱性最强的是NaOH,酸性最强的是HClO4.
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF;
(4)在B、C、D、J、E、F、G、H中,原子半径最大的是Na;
(5)写出D的氢化物的电子式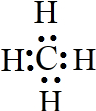 ;
;
(6)E、H的氢化物相互反应,产生白色固体,该固体中存在的化学键类型有离子键、共价键.
(7)用电子式表化合物BH的形成过程: .
.
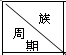 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
(2)最高价氧化物的水化物中碱性最强的是NaOH,酸性最强的是HClO4.
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF;
(4)在B、C、D、J、E、F、G、H中,原子半径最大的是Na;
(5)写出D的氢化物的电子式
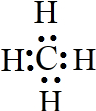 ;
;(6)E、H的氢化物相互反应,产生白色固体,该固体中存在的化学键类型有离子键、共价键.
(7)用电子式表化合物BH的形成过程:
 .
.
17.在室温下,同规格的铝片分别与下列物质混合,化学反应速率最大的是( )
| A. | 18mol/L的浓硫酸15mL L | B. | 0.2mol/L的盐酸12mL | ||
| C. | 0.15mol/L的硫酸溶液8mL | D. | 0.1mol/L的盐酸15m |
 依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题: A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等. .
. .
.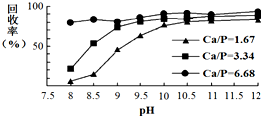 三氯氧磷(POCl3)常温下为无色液体,有广泛应用.近年来,三氯氧磷的工业生产由三氯化磷的“氧气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到).
三氯氧磷(POCl3)常温下为无色液体,有广泛应用.近年来,三氯氧磷的工业生产由三氯化磷的“氧气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到). AgSCN(S)+Cl-(aq);该反应使测定结果偏低;(填偏高,偏低或不变)
AgSCN(S)+Cl-(aq);该反应使测定结果偏低;(填偏高,偏低或不变)