题目内容
3.羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得.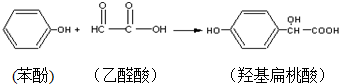
下列有关说法正确的是( )
| A. | 苯酚和羟基扁桃酸互为同系物 | |
| B. | 标准状况下,22.4L羟基扁桃酸中共用电子对的数目为24NA | |
| C. | 乙醛酸的核磁共振氢谱图只有一组峰 | |
| D. | 羟基扁桃酸分子中至少有12个原子共平面 |
分析 A.苯酚和羟基扁桃酸中官能团不完全相同且结构不相似;
B.标况下,羟基扁桃酸是液体,不能用气体摩尔体积计算其体积;
C.乙醛酸分子中有两种氢原子,有几种氢原子其吸收峰就有几组;
D.苯环上所有原子共面,羧基中所有原子共面.
解答 解:A.苯酚和羟基扁桃酸中官能团不完全相同且结构不相似,所以不是同系物,故A错误;
B.标况下,羟基扁桃酸是液体,不能用气体摩尔体积计算其体积,所以无法计算共用电子对数目,故B错误;
C.乙醛酸分子中有两种氢原子,有几种氢原子其吸收峰就有几组,所以乙醛酸有两组吸收峰,故C错误;
D.苯环上所有原子共面,羧基中所有原子共面,所以羟基扁桃酸分子中至少有12个原子共平面,最多有17个原子共面,故D正确;
故选D.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查同系物、原子共面、酚和羧酸等知识点,易错点是D选项.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
14.下列关于钠元素的说法正确的是( )
| A. | 小苏打可以治疗胃酸过多,是利用了小苏打的酸性 | |
| B. | 与足量等浓度盐酸溶液反应的速率:NaHCO3<Na2CO3 | |
| C. | 久置在空气中的钠最后变成碳酸钠晶体 | |
| D. | 某未知样品灼烧时能使火焰呈黄色,说明该样品中肯定含有钠元素 |
11.有人将甲醇设计成为一种燃料电池,并用硫酸作电解质,其中发生的化学反应为:甲醇与氧气反应生成水和二氧化碳(aq表示溶液).该电池负极发生的反应是( )
| A. | CH3OH(g)+O2(g)-2e-=H2O(1)+CO2(g)+2H+(aq) | B. | O2(g)+4H+(aq)+4e-=2H2O(1) | ||
| C. | CH3OH(g)+H2O(1)-6e-=CO2(g)+6H+(aq) | D. | CH3OH(g)+8OH--6e-=CO32-( aq)+6H2O |
8.下列关于化学键的叙述,正确的是( )
| A. | 离子化合物中一定含有离子键 | |
| B. | 单质分子中均不存在化学键 | |
| C. | 含有极性键的分子一定不含非极性键 | |
| D. | 含有共价键的化合物一定是共价化合物 |
15.下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是Ar,只有负化合价而无正价的元素是F,可用于制半导体材料的元素是Si.
(2)最高价氧化物的水化物中碱性最强的是NaOH,酸性最强的是HClO4.
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF;
(4)在B、C、D、J、E、F、G、H中,原子半径最大的是Na;
(5)写出D的氢化物的电子式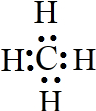 ;
;
(6)E、H的氢化物相互反应,产生白色固体,该固体中存在的化学键类型有离子键、共价键.
(7)用电子式表化合物BH的形成过程: .
.
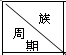 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
(2)最高价氧化物的水化物中碱性最强的是NaOH,酸性最强的是HClO4.
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF;
(4)在B、C、D、J、E、F、G、H中,原子半径最大的是Na;
(5)写出D的氢化物的电子式
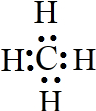 ;
;(6)E、H的氢化物相互反应,产生白色固体,该固体中存在的化学键类型有离子键、共价键.
(7)用电子式表化合物BH的形成过程:
 .
.
13.创建和谐社会,保护生存环境是每一个公民的责任和义务.下列做法不符合人与自然和谐相处的是( )
| A. | 对废旧电池进行回收处理 | |
| B. | 购物时尽量不用塑料袋 | |
| C. | 对聚乙烯等塑料垃圾进行深埋或倾倒入海 | |
| D. | 使用沼气、太阳能、风能等能源替代传统的煤炭 |
 A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等. .
. .
.