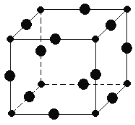
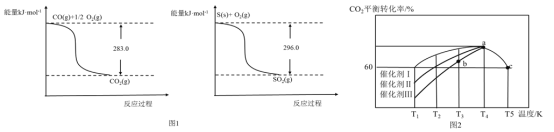
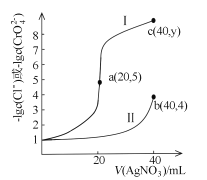
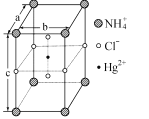
题目内容
【题目】Garnet型固态电解质被认为是锂电池最佳性能固态电解质。LiLaZrTaO材料是目前能达到最高电导率的Garnet型电解质。某Garnet型可充电锂电池放电时工作原理如图所示,反应方程式为:LixC6+Li1-xLaZrTaO![]() LiLaZrTaO+6C,下列说法不正确的是
LiLaZrTaO+6C,下列说法不正确的是
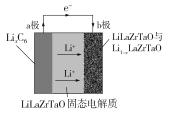
A.放电时,a极为负极,发生氧化反应
B.LiLaZrTaO固态电解质起到传导Li+的作用
C.充电时,b极反应为:LiLaZrTaO -xe-=xLi++Li1-xLaZrTaO
D.充电时,每转移xmol电子,a极增重7 g
【答案】D
【解析】
根据题干信息,由电池工作原理图分析可知,电池工作放电时,Li+向b极移动,则b极为电池的正极,发生还原反应,电极反应式为:xLi++Li1-xLaZrTaO+xe-=LiLaZrTaO,a极为电池的负极,发生氧化反应,据此分析解答问题。
A.根据上述分析可知,电池工作放电时,a极为电池的负极,发生氧化反应,A选项正确;
B.由电池工作原理图可知,LiLaZrTaO固态电解质起到传导Li+的作用,B选项正确;
C.电池充电时,b极为阳极,发生氧化反应,电极反应式为:LiLaZrTaO -xe-=xLi++Li1-xLaZrTaO,C选项正确;
D.充电时,a极为阴极,发生的反应为6C+ xe-+xLi+=LixC6:每转移xmol电子,增重7x g,D选项错误;
答案选D。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案【题目】AlN新型材料应用前景广泛,其制备与性质研究成为热点。
相关数据如下:
物质 | 熔点/℃ | 沸点/℃ | 与N2反应温度/℃ | 相应化合物分解温度/℃ |
Al | 660 | 2467 | >800 | AlN:>2000 (>1400升华) AlCl3:(>181升华) |
Mg | 649 | 1090 | >300 | Mg3N2:>800 |
(1)AlN的制备。
① 化学气相沉积法。
Ⅰ.一定温度下,以AlCl3气体和NH3为原料制备AlN,反应的化学方程式是____________________。
Ⅱ.上述反应适宜的温度范围是______℃(填字母)。
a.75~100 b.600~1100 c.2000~2300
② 铝粉直接氮化法。
Al与N2可直接化合为AlN固体,AlN能将Al包裹,反应难以继续进行。控制温度,在Al粉中均匀掺入适量Mg粉,可使Al几乎全部转化为AlN固体。该过程发生的反应有:__________________、_________和2Al + N2 ![]() 2AlN。
2AlN。
③碳热还原法。
以Al2O3、C(石墨)和N2为原料,在高温下制备AlN。
已知:ⅰ. 2Al2O3(s) 4Al(g) + 3O2(g) H 1 =+3351 kJ·mol-1
ⅱ. 2C(石墨,s) + O2(g) = 2CO(g) H 2 =-221 kJ·mol-1
ⅲ. 2Al(g) + N2(g) = 2AlN(s) H 3 =-318 kJ·mol-1
运用平衡移动原理分析反应ⅱ对反应ⅰ的可能影响:______________________________________。
(2)AlN的性质。AlN粉末可发生水解。相同条件下,不同粒径的AlN粉末水解时溶液pH的变化如图所示。
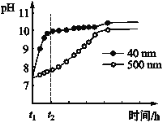
① AlN粉末水解的化学方程式是____________________________________。
② 解释t1-t2时间内两条曲线差异的可能原因:_______________________________。
(3)AlN含量检测。向a g AlN样品中加入足量浓NaOH溶液,然后通入水蒸气将NH3全部蒸出,将NH3用过量的v1 mL c1 mol·L-1 H2SO4溶液吸收完全,剩余的H2SO4用v2 mL c2 mol·L-1 NaOH溶液恰好中和,则样品中AlN的质量分数是________________________________。
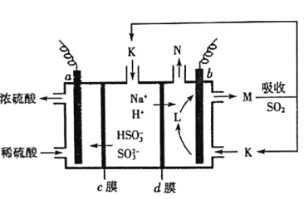
【题目】用“吸收—电解”循环法脱除烟气中的SO2,可减少对大气的污染。室温下,电解液K再生的装置如图所示,其中电解液的pH随![]() 变化的关系见下表,下列对此判断正确的是
变化的关系见下表,下列对此判断正确的是
电解液 | n(SO32-):n(HSO3-) | pH |
K | 9:91 | 6.2 |
L | 1:1 | 7.2 |
M | 91:9 | 8.2 |
A.当电解液呈中性时溶液中:![]()
B.再生液M吸收SO2主反应的离子方程式为:![]()
C.HSO3-在b极发生的电极反应式为:![]()
D.若产生标准状况下2.24L气体N,则d膜上共通过0.2mol阳离子