题目内容
【题目】运用化学反应原理研究化学反应有重要意义。
(1)一氯胺(NH2Cl)是饮用水的二级消毒剂,水解生成一种具有强烈杀菌消毒作用的物质:
①NH2Cl中Cl元素的化合价为_____________。
②NH2Cl发生水解反应的化学方程式为_____________________________。
(2)SO2和CO均为燃煤产生的烟道气中有害成分,在催化作用下可利用二者相互反应进行无害化处理并回收硫。有关资料如图1所示。则:
①常温常压下,质量均为11.2g的CO(g)和S(s)分别完全燃烧生成CO2(g)或SO2(g),放出的热量前者比后者多________kJ。
②SO2(g)+2CO(g)=S(s)+2CO2(g) △H=___________________.
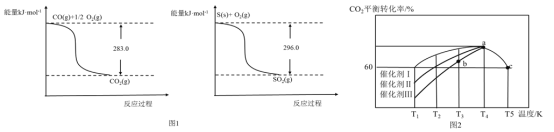
(3)在一定条件下,向恒容密闭容器中充入1.0molCO2和3.0molH2,在一定温度范围内发生如下转化:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-xkJ/mol x>0)。在不同催化剂作用下,相同时间内CO2的转化率随温度的变化如图2所示:
①催化效果最佳的是催化剂__________(选填“I”、“Ⅱ”或“Ⅲ”);b点v(正)___v(逆)(选填“>”、“<”或“=”)
②此反应在a点时已达到平衡状态,a点的转化率比c点高的原因是_____________
(4)常温下,H2CO3的电离常数为:Ka1=4×10-7,Ka2=4×10-11。已知0.1mol/LNH4HCO3溶液的pH=8,则在此溶液中:
①下列有关离子浓度的关系式中,不正确的是_____(填序号)
A.c(NH4+)>c(HCO3-)>c(OH-)>c(H+)
B.c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(H2CO3)
C.c(H2CO3)-c(CO32-)-c(NH3·H2O)=9.9×10-7mol·L-1
②![]() =________(结果保留三位有效数字)。
=________(结果保留三位有效数字)。
【答案】+1 NH2Cl+H2O=NH3+HClO(或NH2Cl+2H2O=NH3·H2O+HClO) 9.6 +270.0kJ/mol I > 该反应为放热反应,升高温度,平衡逆向移动 B 6.25
【解析】
(1)发生水解反应时,元素的化合价一般不发生变化,一氯胺(NH2Cl)水解时能生成有强烈杀菌消毒作用的物质(HClO),可知Cl元素的化合价为+1价;水解的方程式为:NH2Cl+H2O=NH3+HClO(或NH2Cl+2H2O=NH3·H2O+HClO),故答案为:+1;NH2Cl+H2O=NH3+HClO(或NH2Cl+2H2O=NH3·H2O+HClO);
(2)11.2gCO的物质的量为0.4mol,完全燃烧生成CO2放出的热量为283.0kJ×0.4=113.2kJ;11.2gS的物质的量为0.35mol,完全燃烧生成SO2放出的热量为296.0kJ×0.35=103.6kJ,前者比后者放出的热量多9.6kJ;SO2(g)+2CO(g)=S(s)+2CO2(g) △H=296.0kJ/mol-283.0kJ/mol×2=+270.0kJ/mol;故答案为:9.6;+270.0kJ/mol;
(3)根据图2,相同温度时,在催化剂Ⅰ的作用下,反应相同时间CO2的转化率最大,因此催化剂Ⅰ的效果最好;b点时反应还未达到平衡状态,CO2的转化率还会继续增加,反应正向进行,因此v(正)>v(逆);该反应为放热反应,a点时达到平衡,从a点到c点,温度升高,平衡逆向移动,CO2的转化率下降,故答案为:Ⅰ;>;该反应为放热反应,升高温度,平衡逆向移动;
(4)0.1mol/LNH4HCO3溶液中,NH4+水解:NH4++H2O![]() NH3·H2O+H+,HCO3-水解:HCO3-+H2O
NH3·H2O+H+,HCO3-水解:HCO3-+H2O![]() H2CO3+OH-,溶液pH=8,说明HCO3-水解的程度更大;
H2CO3+OH-,溶液pH=8,说明HCO3-水解的程度更大;
①A. 由于NH4HCO3溶液中HCO3-水解的程度更大,离子浓度大小顺序为c(NH4+)>c(HCO3-)>c(OH-)>c(H+),A项正确;
B.NH4+达到水解平衡后,在溶液中的存在形式为NH4+、NH3·H2O,HCO3-达到电离、水解平衡后,在溶液中的存在形式为HCO3-、CO32-、H2CO3,因此物料守恒式为:c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(H2CO3)+c(CO32-),B项错误;
C.列出电荷守恒式:c(NH4+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),与上述物料守恒式联立,得到:c(NH3·H2O) +c(CO32-)+c(OH-)= c(H+)+ c(H2CO3),则c(H2CO3)-c(CO32-)-c(NH3·H2O)=c(OH-)-c(H+)=10-6 mol·L-1-10-8 mol·L-1=9.9×10-7mol·L-1,C项正确;故答案为:B;
②![]() =
=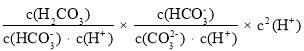 =
= =6.25,故答案为:6.25。
=6.25,故答案为:6.25。

 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案【题目】某小组在Fe2+检验实验中观察到异常现象,为探究“红色褪去”的原因,进行如下实验:
编号 | 实验I | 实验II | 实验III |
实验步骤 |
| 将实验I褪色后的溶液分三份分别进行实验
| 为进一步探究“红色褪去”的原因,又进行以下实验 ① ②取反应后的溶液,滴加盐酸和BaCl2溶液 |
现象 | 溶液先变红,片刻后红色褪去,有气体生成(经检验为O2) | ①无明显现象 ②溶液变红 ③产生白色沉淀 | ①溶液变红,一段时间后不褪色。 ②无白色沉淀产生 |
分析上述三个实验,下列叙述不正确的是
A.在此实验条件下H2O2氧化Fe2+的速率比氧化SCN-的速率快
B.通过实验Ⅱ推出实验Ⅰ中红色褪去的原因是由于SCN-被氧化
C.通过实验Ⅰ和实验Ⅲ对比推出红色褪去只与H2O2的氧化性有关
D.综上所述,实验Ⅰ中红色褪去的原因与化学平衡移动原理无关