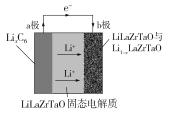
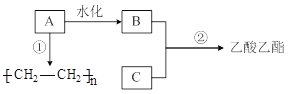
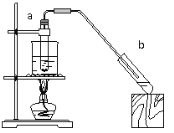
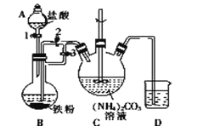
题目内容
【题目】用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是
A. SO2是直线形分子B. SO3是三角锥形分子
C. BF3的键角为120°D. PCl3是平面三角形分子
【答案】C
【解析】
A. SO2中中心S原子价层电子对个数为2+![]() (6-2×1)=4,且S原子上含有2个孤对电子对,所以SO2为V形分子,A错误;
(6-2×1)=4,且S原子上含有2个孤对电子对,所以SO2为V形分子,A错误;
B.SO3中中心S价层电子对个数为3+![]() (6-3×2)=3,是平面三角形分子,B错误;
(6-3×2)=3,是平面三角形分子,B错误;
C.BF3中中心B价层电子对个数为3+![]() (3-3×1)=3,无孤电子对,是平面三角形分子,键角为120°,C正确;
(3-3×1)=3,无孤电子对,是平面三角形分子,键角为120°,C正确;
D. PCl3中中心P价层电子对个数为3+![]() (5-3×1)=4,含有1对孤电子对,所以PCl3是三角锥形分子,D错误;
(5-3×1)=4,含有1对孤电子对,所以PCl3是三角锥形分子,D错误;
故合理选项是C。

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
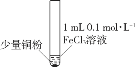
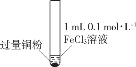
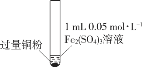
【题目】某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号 | I | II | III |
实验 步骤 |
充分振荡,加2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验 现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀 |
下列说法不正确的是( )
A.实验I、II、III中均发生了反应2Fe3++Cu===2Fe2++Cu2+
B.对比实验I、II、III说明白色沉淀的产生可能与铜粉的量及溶液的阴离子种类有关
C.实验II、III中加入蒸馏水后c(Cu2+)相同
D.向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀