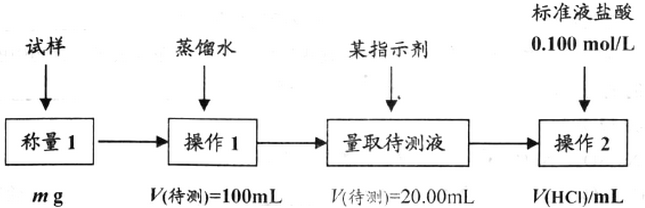
题目内容
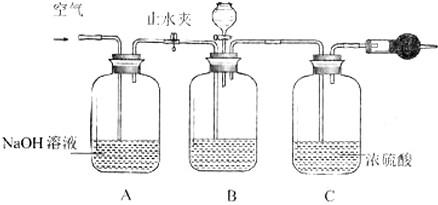
15.实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4.已知K2FeO4具有下列性质①可溶于水、微溶于浓KOH溶液,②在0℃-5℃、强碱性溶液中比较稳定,③在Fe3+和Fe(OH)3催化作用下发生分解,④在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2.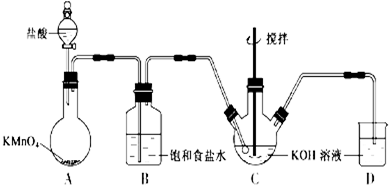
(1)装置A中KMnO4与盐酸反应生成MnCl2和Cl2,其离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,将制备的Cl2通过装置B可除去HCl(填化学式).
(2)Cl2和KOH在较高温度下反应生成KClO3,在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是缓慢滴加盐酸、装置C用冰水浴中.
(3)制备K2FeO4时,KClO饱和溶液与Fe(NO3)3饱和溶液的混合方式为在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO 饱和溶液中.
(4)提纯K2FeO4粗产品[含有Fe(OH)3、KCl等杂质]的实验方案为:将一定量的K2FeO4粗产品溶于冷的3mol•L-1KOH溶液中,用砂芯漏斗过滤,将滤液置于冰水浴中,向滤液中加入饱和的KOH溶液,再用砂芯漏斗过滤,晶体用乙醇洗涤2-3次后,在真空干燥箱中干燥(实验中须使用的试剂有:饱和KOH溶液,乙醇;除常用仪器外须使用的仪器有:砂芯漏斗,真空干燥箱).
分析 (1)KMnO4具有强氧化性,将盐酸中氯离子氧化为Cl2,反应还有水生成,KMnO4、HCl、MnCl2改写成离子形式,Cl2、H2O为分子式形式,配平书写离子方程式;
由于盐酸易挥发,制备的氯气中含有HCl,应饱和食盐水吸收HCl除去;
(2)Cl2和KOH在较高温度下反应生成KClO3,制取KClO温度反应在0℃~5℃,装置C应放在冰水浴中,充分利用原料,应降低通入氯气的速率;
(3)K2FeO4在Fe3+和Fe(OH)3催化作用下发生分解,应把Fe(NO3)3饱和溶液滴加到KClO溶液中;
(4)用砂芯漏斗过滤,除去氢氧化铁,由于K2FeO4可溶于水、微溶于浓KOH溶液,将滤液置于冰水浴中,向滤液中加入饱和的KOH溶液,析出K2FeO4晶体,再进行过滤,用乙醇洗涤,减少因溶解导致晶体损失,最后在真空干燥箱中干燥.
解答 解:(1)KMnO4具有强氧化性,将盐酸中氯离子氧化为Cl2,反应还有水生成,KMnO4、HCl、MnCl2改写成离子形式,Cl2、H2O为分子式形式,离子方程式为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,
由于盐酸易挥发,制备的氯气中含有HCl,应饱和食盐水吸收HCl除去,
故答案为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;HCl;
(2)Cl2和KOH在较高温度下反应生成KClO3,制取KClO温度反应在0℃~5℃,装置C应放在冰水浴中,充分利用原料,缓慢滴加盐酸,减慢生成氯气的速率,
故答案为:缓慢滴加盐酸、装置C用冰水浴中;
(3)K2FeO4在Fe3+和Fe(OH)3催化作用下发生分解,应把Fe(NO3)3饱和溶液滴加到KClO溶液中,具体操作为:在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO 饱和溶液中,
故答案为:在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO 饱和溶液中;
(4)提纯K2FeO4粗产品[含有Fe(OH)3、KCl等杂质]的实验方案为:将一定量的K2FeO4粗产品溶于冷的3mol•L-1KOH溶液中,用砂芯漏斗过滤,将滤液置于冰水浴中,向滤液中加入饱和的KOH溶液,再用砂芯漏斗过滤,晶体用乙醇洗涤2-3次后,在真空干燥箱中干燥,
故答案为:用砂芯漏斗过滤,将滤液置于冰水浴中,向滤液中加入饱和--的KOH溶液,再用砂芯漏斗过滤,晶体用乙醇洗涤2-3次后,在真空干燥箱中干燥.
点评 本题考查实验制备方案、氧化还原反应、物质的分离提纯、对条件与操作的分析评价、阅读获取信息能力,是对学生综合能力的考查,注意题目信息的迁移运用,难度中等.

Ⅰ.从海水中提取食盐和溴的过程如下:

(1)请列举海水淡化的三种方法:蒸馏法、电渗析法、离子交换法.
(2)用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质.某次除杂操作时,往粗盐水中先加入过量的BaCl2(填化学式),至沉淀不再产生后,继续加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去.经检测发现滤液中仍含有一定量的SO42-,已知Ksp(BaSO4)=1.1×10-10、Ksp(BaCO3)=5.1×10-9,请分析滤液中仍含有SO42-的原因是:BaSO4和BaCO3的Ksp相差不大,当溶液中存在大量CO32-时,BaSO4(s)会部分转化为BaCO3(s).将提纯后的NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、Cl2、NaOH或H2、NaClO.
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为富集溴元素.
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为:
Br2+SO2+2H2O═4H++SO42-+2Br-,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是强酸对设备的严重腐蚀.
Ⅱ.按以下实验方案可从海洋动物炳海鞘中提取具有抗肿瘤活性的天然产物.

(5)下列叙述正确的是a、b、d(填序号).
a.步骤①需要过滤装置 b.步骤②需要用到分液漏斗
c.步骤③需要用到坩埚 d.步骤④需要蒸馏装置
Ⅲ.海水淡化后剩余的浓海水经过一系列工艺流程可以获取其他产品,如Mg(OH)2等.浓海水的主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |

关于它们的说法中正确的是( )
| A. | Y遇到氯化铁溶液时显紫色,X能使溴的四氯化碳溶液褪色 | |
| B. | X含3个手性碳原子 | |
| C. | 1mol X与足量NaOH溶液反应,最多可消耗3mol NaOH | |
| D. | 1个Y分子中最多有8个原子共面 |
| 选项 | 实验目的 | 主要仪器 | 试剂 |
| A | 测定中和热 | 量筒、温度计、酒精灯 | 盐酸、NaOH溶液 |
| B | 制备氢氧化铁胶体 | 烧杯、胶头滴管、酒精灯 | 饱和FeCl3溶液 |
| C | 配制10%CuSO4溶液100g | 100ml 容量瓶、玻璃棒 | 胆矾 |
| D | 实验室制取、收集干燥的氨气 | 大试管、酒精灯 | 氯化铵、消石灰、无水CaCl2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 若某温度下,0.2 mol/L的醋酸与0.09 mol/L的氢氧化钡等体积混合后呈中性(不考虑混合后溶液体积的变化),则可算出该温度下醋酸的电离常数 K=9×10-7 mol/L | |
| B. | 若某温度下氯化银的Ksp=10-10mol2/L2,则100 mL0.2 mol/L的氯化钠溶液与0.18 mol/L硝酸银溶液等体积混合后(不考虑混合后溶液体积的变化),溶液中c(Ag+)为10-8 mol/L | |
| C. | 若某温度下1 L密闭容器中反应HCHO(g)十H2(g)?CH3OH(g)达到平衡后甲醛的转化率为50%,则该温度下该反应的平衡常数是2(mol/L)-1 | |
| D. | 若向氢氧化钙的饱和溶液中加人氢氧化钠溶液,则会有固体析出 |
| A. | 双氧水分解时加入二氧化锰 | B. | 将块状药品研细后在进行反应 | ||
| C. | 用较浓的盐酸代替稀盐酸与锌反应 | D. | 将易腐败的食物储存在冰箱里 |