题目内容
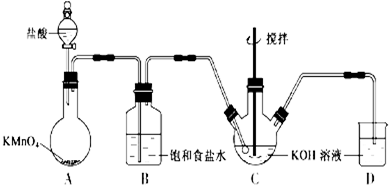
5.海洋是巨大的资源宝库,具有非常广阔的开发前景.Ⅰ.从海水中提取食盐和溴的过程如下:

(1)请列举海水淡化的三种方法:蒸馏法、电渗析法、离子交换法.
(2)用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质.某次除杂操作时,往粗盐水中先加入过量的BaCl2(填化学式),至沉淀不再产生后,继续加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去.经检测发现滤液中仍含有一定量的SO42-,已知Ksp(BaSO4)=1.1×10-10、Ksp(BaCO3)=5.1×10-9,请分析滤液中仍含有SO42-的原因是:BaSO4和BaCO3的Ksp相差不大,当溶液中存在大量CO32-时,BaSO4(s)会部分转化为BaCO3(s).将提纯后的NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、Cl2、NaOH或H2、NaClO.
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为富集溴元素.
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为:
Br2+SO2+2H2O═4H++SO42-+2Br-,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是强酸对设备的严重腐蚀.
Ⅱ.按以下实验方案可从海洋动物炳海鞘中提取具有抗肿瘤活性的天然产物.

(5)下列叙述正确的是a、b、d(填序号).
a.步骤①需要过滤装置 b.步骤②需要用到分液漏斗
c.步骤③需要用到坩埚 d.步骤④需要蒸馏装置
Ⅲ.海水淡化后剩余的浓海水经过一系列工艺流程可以获取其他产品,如Mg(OH)2等.浓海水的主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
分析 (1)除去海水中的盐分以获得淡水的工艺过程叫海水淡化,亦称海水脱盐.海水淡化的方法,基本上分为两大类:
①在除杂的过程中每步加入的试剂必须是过量的,使离子除尽;过量的离子在下一步中必须出去,故先加入BaCl2,除去硫酸根,过量的钡离子,加入Na2CO3除去.根据提供的Ksp数据,在后面加入碳酸钠时,发生BaSO4(s)+CO32- (aq)=BaCO3(s)+SO42- (aq);从海水中取淡水,有蒸留法、反渗透法、水合物法、溶剂萃取法和冰冻法;
②除去海水中的盐分,有电渗拆法、离子交换法和压渗法;
(2)电解饱和氯化钠溶液,在阳极上产生氯气,阴极上产生氢气,同时生成了氢氧化钠;如果氯气遇到氢氧化钠溶液可反应生成次氯酸钠;
(3)海水淡化得到的母液和电解氯化钠溶液生成的氯气反应,得到的溴单质浓度低,溴单质在水中有一定的溶解性且和水反应,提取时消耗过的能源和原料,降低了经济效益;
(4)SO2吸收溴,依据氧化还原反应生成物书写基本规律,Br元素在自然中-1价稳定.由于此反应有强酸HBr和H2SO4生成,易腐蚀设备,顺利写出工业生产需要解决的问题;
(5)步骤①是分离固液混合物,其操作为过滤,步骤②分离互不相溶的液体混合物,需进行分液,要用到分液漏斗;步骤③是从溶液中得到固体,操作为蒸发,需要蒸发皿;步骤④是从有机化合物中,利用沸点不同采取蒸馏得到甲苯;
(6)根据Mg2+~Mg(OH)2计算氢氧化镁的质量.
解答 解:(1)从海水中取淡水,有蒸留法、反渗透法、水合物法、溶剂萃取法和冰冻法,除去海水中的盐分,有电渗拆法、离子交换法和压渗法,故答案为:蒸馏法;电渗析法;离子交换法;
(2)加入过量的Na2CO3和NaOH,可分别除去Ca2+、Mg2+,在除杂的过程中每步加入的试剂必须是过量的,使离子除尽;过量的离子在下一步中必须出去,故先加入BaCl2,除去硫酸根,过量的钡离子,加入Na2CO3除去.BaSO4和BaCO3的Ksp相差不大,当溶液中存在大量CO32-时,发生BaSO4(s)+CO32- (aq)=BaCO3(s)+SO42- (aq),BaSO4(s)会部分转化为BaCO3(s);电解NaCl溶液:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑,若产生的Cl2直接与溶液中NaOH反应,可以生产消毒液NaClO,
故答案为:BaCl2;BaSO4和BaCO3的Ksp相差不大,当溶液中存在大量CO32-时,BaSO4(s)会部分转化为BaCO3(s);Cl2;NaOH;NaClO;
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,目的是低浓度的Br2溶液在提取时消耗过多的原料和能源,转化为HBr后易被氧化剂氯气氧化为溴单质,用于富集溴元素,故答案为:富集溴元素;
(4)二氧化硫吸收溴单质发生反应,SO2+Br2+2H2O=H2SO4+2HBr,离子方程式为SO2+Br2+2H2O═4H++2Br-+SO42-,环境保护主要是减少SO2气体的损耗和排放,工业生产中应解决的主要问题是反应生成了两种强酸,易腐蚀设备,
故答案为:SO2+Br2+2H2O═4H++2Br-+SO42-;强酸对设备的严重腐蚀;
(5)a.步骤①是分离固液混合物,其操作为过滤,需要过滤装置,故a正确;
b.步骤②分离互不相溶的液体混合物,需进行分液,要用到分液漏斗,故b正确;
c.步骤③是从溶液中得到固体,操作为蒸发,需要蒸发皿,而不用坩埚,故c错误;
d.步骤④是从有机化合物中,利用沸点不同采取蒸馏得到甲苯,需要蒸馏装置,故d正确;
故答案为:a、b、d;
(6)溶液中m(Mg2+)=1L×28.8g/L=28.8g,
Mg2+~Mg(OH)2
24g 58g
28.8g m[Mg(OH)2]
m[Mg(OH)2]=28.8g×$\frac{58g}{24g}$=69.6g,故答案为:69.6.
点评 本题考查了海水资源的综合利用,海水提溴工艺,物质的分离提纯等,注意合成流程中物质的性质及分离方法是解答本题的关键,注重实验操作和分离方法的考查,题目难度不大.


| A. | 在NaOH水溶液中加热,化合物X可发生消去反应 | |
| B. | 在一定条件,化合物Y可与HCHO发生缩聚反应 | |
| C. | 用FeCl3溶液可鉴别化合物X和Y | |
| D. | 化合物Y中不含有手性碳原子 |
| A. | pH=1的溶液中:Fe2+、Cl-、NO3-、K+ | |
| B. | 滴入酚酞显红色的溶液中:Na+、Al3+、CO32-、AlO2- | |
| C. | 加入铝粉产生H2的溶液中:Fe2+、Na+、SO42-、ClO- | |
| D. | 0.1mol•L-1 NaHCO3溶液中:Na+、NH4+、SO42-、NO3- |
| A. | 甲苯与氯气在光照下反应主要生成2,4-二氯甲苯 | |
| B. | 用乙醇和浓硫酸制备乙烯时,可用水浴加热控制反应的温度 | |
| C. | 1 mol葡萄糖能水解生成2 mol CH3CH2OH和2 mol CO2 | |
| D. | 实验室中提纯混有少量乙酸的乙醇,可采用先加生石灰,过滤后再蒸馏的方法 |
方案Ⅰ:利用锌与足量稀硫酸反应制氢气,氢气还原氧化铜;
方案Ⅱ:氧化铜溶于稀硫酸生成硫酸铜,然后用锌与硫酸铜反应制备铜.
下列关于方案Ⅰ和Ⅱ的评价不正确的是( )
| A. | 方案Ⅱ比方案Ⅰ操作简便 | |
| B. | 等质量的锌,相同条件下方案Ⅰ和方案Ⅱ中制得的铜的质量相同 | |
| C. | 等质量的H2SO4参加反应,方案Ⅰ制取铜的质量比方案Ⅱ的少 | |
| D. | 为了加快锌与稀硫酸反应,可以在溶液中加入少量氧化铜 |
| A. | 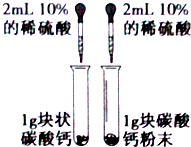 用图装置探究反应物接触面积对反应速率影响 | |
| B. | 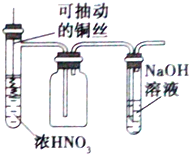 用图装置制取并收集少量的NO2气体(不考虑倒吸) | |
| C. |  用图装置制取并收集少量的氯气 | |
| D. |  用图装置制取少量乙酸乙酯 |
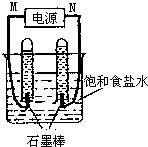 利用反应CO(g)+H2(g)+O2(g)?H2O(g)+CO2(g)设计而成的MCFS燃料电池是一种新型电池.现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置及现象如图所示.则①M应是电源的负极(填“正”或“负”);②该电解反应的化学方程式是2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;③已知饱和食盐水的体积为1L,一段时间后,测得左侧试管中气体体积为11.2mL(标准状况),若电解前后溶液的体积变化忽略不计,电解后将溶液混合均匀,此时溶液的pH为11.
利用反应CO(g)+H2(g)+O2(g)?H2O(g)+CO2(g)设计而成的MCFS燃料电池是一种新型电池.现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置及现象如图所示.则①M应是电源的负极(填“正”或“负”);②该电解反应的化学方程式是2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;③已知饱和食盐水的体积为1L,一段时间后,测得左侧试管中气体体积为11.2mL(标准状况),若电解前后溶液的体积变化忽略不计,电解后将溶液混合均匀,此时溶液的pH为11.