题目内容
14.用下列实验装置完成对应的实验,能达到实验目的且合理的是( )| A. | 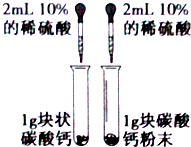 用图装置探究反应物接触面积对反应速率影响 | |
| B. | 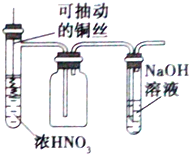 用图装置制取并收集少量的NO2气体(不考虑倒吸) | |
| C. |  用图装置制取并收集少量的氯气 | |
| D. |  用图装置制取少量乙酸乙酯 |
分析 A.硫酸和碳酸钙反应生成难溶性的硫酸钙;
B.浓硝酸和Cu反应生成二氧化氮,二氧化氮密度大于空气,应该采用向上排空气法收集,二氧化氮和NaOH反应生成盐;
C.电解池中,较活泼金属作阳极时,阳极上金属失电子;
D.制取乙酸乙酯时用饱和碳酸钠除杂.
解答 解:A.硫酸和碳酸钙反应生成难溶性的硫酸钙而阻止进一步反应,所以不能实现实验目的,故A错误;
B.浓硝酸和Cu反应生成二氧化氮,二氧化氮密度大于空气,应该采用向上排空气法收集,二氧化氮和NaOH反应生成盐,所以能实现实验目的,故B正确;
C.电解池中,较活泼金属作阳极时,阳极上金属失电子,所以阳极上Cu失电子生成铜离子而不是氯气,故C错误;
D.制取乙酸乙酯时用饱和碳酸钠除杂,NaOH能促进乙酸乙酯水解,应该用饱和碳酸钠溶液,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及物质制备、气体制备和收集、探究反应速率影响因素等知识点,明确实验原理是解本题关键,从操作规范性及物质性质来分析解答,易错选项是D,题目难度不大.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
4.下列转化及解释均正确的是( )
| 转化 | 解释 | |
| A | CuS+H2SO4=CuSO4+H2S↑ | 酸性:H2SO4>H2S |
| B | AgCl(s)+I-(aq)?AgI(s)+Cl-(aq) | Kap(AgCl)<Kap(AgI) |
| C | 2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;Fe+S$\frac{\underline{\;加热\;}}{\;}$FeS | 氧化性:Cl2>S |
| D | C(s,石墨)=C(s,金刚石)△H=+1.9kL/mol | 稳定性:石墨<金刚石 |
| A. | A | B. | B | C. | C | D. | D |
5.海洋是巨大的资源宝库,具有非常广阔的开发前景.
Ⅰ.从海水中提取食盐和溴的过程如下:

(1)请列举海水淡化的三种方法:蒸馏法、电渗析法、离子交换法.
(2)用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质.某次除杂操作时,往粗盐水中先加入过量的BaCl2(填化学式),至沉淀不再产生后,继续加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去.经检测发现滤液中仍含有一定量的SO42-,已知Ksp(BaSO4)=1.1×10-10、Ksp(BaCO3)=5.1×10-9,请分析滤液中仍含有SO42-的原因是:BaSO4和BaCO3的Ksp相差不大,当溶液中存在大量CO32-时,BaSO4(s)会部分转化为BaCO3(s).将提纯后的NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、Cl2、NaOH或H2、NaClO.
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为富集溴元素.
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为:
Br2+SO2+2H2O═4H++SO42-+2Br-,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是强酸对设备的严重腐蚀.
Ⅱ.按以下实验方案可从海洋动物炳海鞘中提取具有抗肿瘤活性的天然产物.

(5)下列叙述正确的是a、b、d(填序号).
a.步骤①需要过滤装置 b.步骤②需要用到分液漏斗
c.步骤③需要用到坩埚 d.步骤④需要蒸馏装置
Ⅲ.海水淡化后剩余的浓海水经过一系列工艺流程可以获取其他产品,如Mg(OH)2等.浓海水的主要成分如下:
(6)理论上,1L浓海水最多可得到Mg(OH)2的质量为69.6 g.
Ⅰ.从海水中提取食盐和溴的过程如下:

(1)请列举海水淡化的三种方法:蒸馏法、电渗析法、离子交换法.
(2)用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质.某次除杂操作时,往粗盐水中先加入过量的BaCl2(填化学式),至沉淀不再产生后,继续加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去.经检测发现滤液中仍含有一定量的SO42-,已知Ksp(BaSO4)=1.1×10-10、Ksp(BaCO3)=5.1×10-9,请分析滤液中仍含有SO42-的原因是:BaSO4和BaCO3的Ksp相差不大,当溶液中存在大量CO32-时,BaSO4(s)会部分转化为BaCO3(s).将提纯后的NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、Cl2、NaOH或H2、NaClO.
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为富集溴元素.
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为:
Br2+SO2+2H2O═4H++SO42-+2Br-,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是强酸对设备的严重腐蚀.
Ⅱ.按以下实验方案可从海洋动物炳海鞘中提取具有抗肿瘤活性的天然产物.

(5)下列叙述正确的是a、b、d(填序号).
a.步骤①需要过滤装置 b.步骤②需要用到分液漏斗
c.步骤③需要用到坩埚 d.步骤④需要蒸馏装置
Ⅲ.海水淡化后剩余的浓海水经过一系列工艺流程可以获取其他产品,如Mg(OH)2等.浓海水的主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
2.工业上合成尿素的反应:
2NH3(g)+CO2(g)?CO(NH2)2(I)+H2O(I)△H(I)
(1)已知合成尿素的反应分两步进行:
2NH3(g)+CO2(g)?NH2COONH4(s)△H1
NH2COONH4(s)?CO(NH2)2(I)+H2O(I)△H2
其能量变化曲线如图1所示,则△H、△H1和△H2由大到小的顺序为△H2>△H>△H1.
(2)在一个真空恒容密闭容器中充入CO2和NH3发生反应(I)合成尿素,恒定温度下混合气体中NH3的体积分数如图2所示.
A点的正反应速率v正(CO2)>B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);CO2的平衡转化率为75%.
(3)将一定量的氨基甲酸铵固体置于恒容真空容器中,发生反应:H2NCOONH4(s)?2NH3(g)+CO2(g).在不同温度(T1和T2)下,该反应达平衡状态时部分数据见下表.
①T1< T2 (填“>”、“<”或“=”).
②下列能说明该分解反应达到平衡状态的是ac(填代号).
a.v生成(NH3)=2v消耗(CO2)
b.密闭容器内物质的总质量不变
c.密闭容器中混合气体的密度不变
d.密闭容器中氨气的体积分数不变
(4)氨基甲酸铵极易水解成碳酸铵,酸性条件下水解更彻底.25℃时,向1L 0.1mol•L-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.此时溶液中c(NH4+)=0.1mol/L;NH4+水解平衡常数值为4×10-9.

2NH3(g)+CO2(g)?CO(NH2)2(I)+H2O(I)△H(I)
(1)已知合成尿素的反应分两步进行:
2NH3(g)+CO2(g)?NH2COONH4(s)△H1
NH2COONH4(s)?CO(NH2)2(I)+H2O(I)△H2
其能量变化曲线如图1所示,则△H、△H1和△H2由大到小的顺序为△H2>△H>△H1.
(2)在一个真空恒容密闭容器中充入CO2和NH3发生反应(I)合成尿素,恒定温度下混合气体中NH3的体积分数如图2所示.
A点的正反应速率v正(CO2)>B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);CO2的平衡转化率为75%.
(3)将一定量的氨基甲酸铵固体置于恒容真空容器中,发生反应:H2NCOONH4(s)?2NH3(g)+CO2(g).在不同温度(T1和T2)下,该反应达平衡状态时部分数据见下表.
| 温度 | 平衡浓度/(mol•L-1) | |
| c(NH3) | c(CO2) | |
| T1 | 0.1 | |
| T2 | 0.1 | |
②下列能说明该分解反应达到平衡状态的是ac(填代号).
a.v生成(NH3)=2v消耗(CO2)
b.密闭容器内物质的总质量不变
c.密闭容器中混合气体的密度不变
d.密闭容器中氨气的体积分数不变
(4)氨基甲酸铵极易水解成碳酸铵,酸性条件下水解更彻底.25℃时,向1L 0.1mol•L-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.此时溶液中c(NH4+)=0.1mol/L;NH4+水解平衡常数值为4×10-9.

9.下面说法中正确的是( )
| A. | 标有“ ”的包装材料可以用来包装食品 ”的包装材料可以用来包装食品 | |
| B. | 酒精消毒原理是将病毒彻底氧化 | |
| C. | GaN中的氮和镓均属于第IIIA族元素 | |
| D. | 麦芽糖的水解产物能发生银镜反应 |
3.体育竞技中服用兴奋剂既有失公平,也破坏了体育道德,以下是其中检测出的两种兴奋剂的结构:
关于它们的说法中正确的是( )

关于它们的说法中正确的是( )
| A. | Y遇到氯化铁溶液时显紫色,X能使溴的四氯化碳溶液褪色 | |
| B. | X含3个手性碳原子 | |
| C. | 1mol X与足量NaOH溶液反应,最多可消耗3mol NaOH | |
| D. | 1个Y分子中最多有8个原子共面 |
9.下列说法正确的是( )
| A. | 若某温度下,0.2 mol/L的醋酸与0.09 mol/L的氢氧化钡等体积混合后呈中性(不考虑混合后溶液体积的变化),则可算出该温度下醋酸的电离常数 K=9×10-7 mol/L | |
| B. | 若某温度下氯化银的Ksp=10-10mol2/L2,则100 mL0.2 mol/L的氯化钠溶液与0.18 mol/L硝酸银溶液等体积混合后(不考虑混合后溶液体积的变化),溶液中c(Ag+)为10-8 mol/L | |
| C. | 若某温度下1 L密闭容器中反应HCHO(g)十H2(g)?CH3OH(g)达到平衡后甲醛的转化率为50%,则该温度下该反应的平衡常数是2(mol/L)-1 | |
| D. | 若向氢氧化钙的饱和溶液中加人氢氧化钠溶液,则会有固体析出 |