题目内容
2.工业上合成尿素的反应:2NH3(g)+CO2(g)?CO(NH2)2(I)+H2O(I)△H(I)
(1)已知合成尿素的反应分两步进行:
2NH3(g)+CO2(g)?NH2COONH4(s)△H1
NH2COONH4(s)?CO(NH2)2(I)+H2O(I)△H2
其能量变化曲线如图1所示,则△H、△H1和△H2由大到小的顺序为△H2>△H>△H1.
(2)在一个真空恒容密闭容器中充入CO2和NH3发生反应(I)合成尿素,恒定温度下混合气体中NH3的体积分数如图2所示.
A点的正反应速率v正(CO2)>B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);CO2的平衡转化率为75%.
(3)将一定量的氨基甲酸铵固体置于恒容真空容器中,发生反应:H2NCOONH4(s)?2NH3(g)+CO2(g).在不同温度(T1和T2)下,该反应达平衡状态时部分数据见下表.
| 温度 | 平衡浓度/(mol•L-1) | |
| c(NH3) | c(CO2) | |
| T1 | 0.1 | |
| T2 | 0.1 | |
②下列能说明该分解反应达到平衡状态的是ac(填代号).
a.v生成(NH3)=2v消耗(CO2)
b.密闭容器内物质的总质量不变
c.密闭容器中混合气体的密度不变
d.密闭容器中氨气的体积分数不变
(4)氨基甲酸铵极易水解成碳酸铵,酸性条件下水解更彻底.25℃时,向1L 0.1mol•L-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.此时溶液中c(NH4+)=0.1mol/L;NH4+水解平衡常数值为4×10-9.
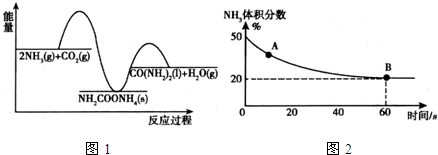
分析 (1)根据能量图可以分析,2NH3(g)+CO2(g)?CO(NH2)2(I)+H2O(I)为放热反应,所以△H<0,2NH3(g)+CO2(g)?NH2COONH4(s)为放热反应,所以△H1
<0,并且△H1<△H<0,NH2COONH4(s)?CO(NH2)2(I)+H2O(I)为吸热反应,所以△H2>0,据此分析;
(2)图象分析氨气的体积分数从50%变化为20%后体积分数保持不变,说明B点反应达到平衡状态,A点氨气体积百分含量大于B的氨气体积百分含量,说明反应正向进行达到平衡状态,A点的正反应速率大于B点的正反应速率;依据氨气的体积分数结合平衡三段式列式计算平衡转化率;
(3)①根据(1)的分析,2NH3(g)+CO2(g)?NH2COONH4(s)为放热反应,所以,△H1<0,所以H2NCOONH4(s)?2NH3(g)+CO2(g)为吸热反应,温度越高平衡产物越多,据此分析;
②当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变,以此进行判断;
(4)根据氨基甲酸铵极易水解成碳酸铵,即反应式为NH2COONH4(s)+H2O?(NH4)2CO3,将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7并且溶液中几乎不含碳元素,所以溶液中只有H+、NH4+、OH-、Cl-,根据电荷守恒计算c(NH4+),根据NH4++H2O?NH3•H2O+OH-结合K=$\frac{c(NH{\;}_{3}•H{\;}_{2}O)c(H{\;}^{+})}{c(NH{\;}_{4}{\;}^{+})}$进行计算.
解答 解:(1)根据能量图可以分析,2NH3(g)+CO2(g)?CO(NH2)2(I)+H2O(I)为放热反应,所以△H<0,2NH3(g)+CO2(g)?NH2COONH4(s)为放热反应,所以△H1<0,并且△H1<△H<0,NH2COONH4(s)?CO(NH2)2(I)+H2O(I)为吸热反应,所以△H2>0,所以△H2>△H>△H1;故答案为:△H2>△H>△H1;
(2)氨气的体积分数从50%变化为20%后体积分数保持不变,说明B点反应达到平衡状态,A点氨气体积百分含量大于B的氨气体积百分含量,说明反应正向进行达到平衡状态,A点的正反应速率大于B点的正反应速率,故v正(CO2)>v逆(CO2);
设氨气消耗物质的量x,开始氨气体积分数为50%,假设氨气为50mol,二氧化碳为50mol,
CO2+2NH3?(NH2)2CO+H2O
起始量(mol) 50 50 0 0
变化量(mol) 0.5x x 0.5x 0.5x
平衡量(mol) 50-0.5x 50-x 0.5x 0.5x
氨气的体积分数=$\frac{50-x}{50-0.5x+50-x+0.5x}$=20%;解得x=37.5mol,
氨气的平衡转化率=$\frac{37.5mol}{50mol}$×100%=75%,
故答案为:>;75%;
(2)①根据(1)的分析,2NH3(g)+CO2(g)?NH2COONH4(s)为放热反应,所以,△H1<0,所以H2NCOONH4(s)?2NH3(g)+CO2(g)为吸热反应,温度越高平衡产物越多,又T1平衡时c(NH3)为0.1mol/L,则二氧化碳浓度为0.05mol/L,又T2平衡时二氧化碳浓度为0.1mol/L,所以T1<T2;故答案为:<;
②a.根据反应速率之比等于系数之比,则v生成(NH3)=2v生成(CO2)=2v消耗(CO2),所以正逆反应速率相等,能判断平衡,故a正确;
b.根据质量守恒,密闭容器内物质的总质量一直不变,所以不能判断平衡,故b错误;
c.因为该反应正反应为气体质量增加的反应,又体积不变,所以密闭容器中混合气体的密度一直在变,则当密度不变时,能判断平衡,故c正确;
d.因为反应物为固体,所以生成物氨气和二氧化碳一直为2:1,则密闭容器中氨气的体积分数一直不变,所以不能判断平衡,故d错误;
故选:ac;
(4)因为氨基甲酸铵极易水解成碳酸铵,即反应式为NH2COONH4(s)+H2O?(NH4)2CO3,加入1L0.1mol/L的盐酸溶液中直到溶液pH=7并且溶液中几乎不含碳元素,所以溶液中只有H+、NH4+、OH-、Cl-,根据电荷守恒c(NH4+)=c(Cl-)=0.1mol/L,又用去0.052mol氨基甲酸铵,所以开始溶液中的铵根离子浓度为0.052mol/L×2=0.104mol/L,
NH4++H2O?NH3•H2O+H+;
开始 0.104mol/L 0
转化 0.004mol/L 0.004mol/L
平衡 0.1mol/L 0.004mol/L
又溶液为pH=7,所以氢离子浓度为10-7mol/L,则NH4+水解平衡常数K=$\frac{c(NH{\;}_{3}•H{\;}_{2}O)c(H{\;}^{+})}{c(NH{\;}_{4}{\;}^{+})}$=$\frac{0.004×10{\;}^{-7}}{0.1}$=4×10-9,故答案为:0.1mol/L;4×10-9.
点评 本题考查化学反应速率、化学平衡的移动原理、弱碱根离子在溶液中的水解平衡的计算应用等知识,综合性较大,难度中等.

方案Ⅰ:利用锌与足量稀硫酸反应制氢气,氢气还原氧化铜;
方案Ⅱ:氧化铜溶于稀硫酸生成硫酸铜,然后用锌与硫酸铜反应制备铜.
下列关于方案Ⅰ和Ⅱ的评价不正确的是( )
| A. | 方案Ⅱ比方案Ⅰ操作简便 | |
| B. | 等质量的锌,相同条件下方案Ⅰ和方案Ⅱ中制得的铜的质量相同 | |
| C. | 等质量的H2SO4参加反应,方案Ⅰ制取铜的质量比方案Ⅱ的少 | |
| D. | 为了加快锌与稀硫酸反应,可以在溶液中加入少量氧化铜 |
| A. | 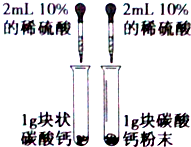 用图装置探究反应物接触面积对反应速率影响 | |
| B. |  用图装置制取并收集少量的NO2气体(不考虑倒吸) | |
| C. |  用图装置制取并收集少量的氯气 | |
| D. | 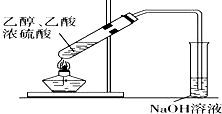 用图装置制取少量乙酸乙酯 |
| A. | C$\stackrel{在空气中点燃}{→}$CO$\stackrel{CuO,△}{→}$CO2$\stackrel{NaOH溶液}{→}$Na2CO3 | |
| B. | Cu$\stackrel{AgNO_{3}溶液}{→}$Cu(NO3)2溶液$\stackrel{NaOH溶液}{→}$Cu(OH)2 | |
| C. | Fe$\stackrel{点燃}{→}$Fe2O3$\stackrel{H_{2}SO_{4}溶液}{→}$Fe2(SO4)3溶液 | |
| D. | CaO$\stackrel{H_{2}O}{→}$Ca(OH)2溶液$\stackrel{Na_{2}CO_{3}}{→}$NaOH溶液 |
 叶酸是维生素B族之一,可以由下列甲、乙、丙三种物质合成.
叶酸是维生素B族之一,可以由下列甲、乙、丙三种物质合成. .
.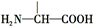
 +2NaOH→HOCH2CH(NH2)COONa+H2O+CH3COONa.
+2NaOH→HOCH2CH(NH2)COONa+H2O+CH3COONa.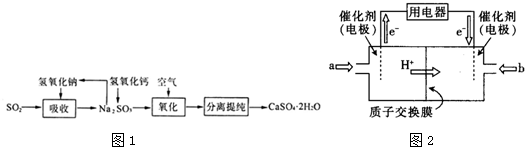
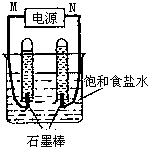 利用反应CO(g)+H2(g)+O2(g)?H2O(g)+CO2(g)设计而成的MCFS燃料电池是一种新型电池.现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置及现象如图所示.则①M应是电源的负极(填“正”或“负”);②该电解反应的化学方程式是2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;③已知饱和食盐水的体积为1L,一段时间后,测得左侧试管中气体体积为11.2mL(标准状况),若电解前后溶液的体积变化忽略不计,电解后将溶液混合均匀,此时溶液的pH为11.
利用反应CO(g)+H2(g)+O2(g)?H2O(g)+CO2(g)设计而成的MCFS燃料电池是一种新型电池.现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置及现象如图所示.则①M应是电源的负极(填“正”或“负”);②该电解反应的化学方程式是2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;③已知饱和食盐水的体积为1L,一段时间后,测得左侧试管中气体体积为11.2mL(标准状况),若电解前后溶液的体积变化忽略不计,电解后将溶液混合均匀,此时溶液的pH为11.