题目内容
19.向一定量的NaOH溶液中,通入标准状况下2.24L CO2使其充分反应,所的溶液中所含溶质的总质量为9.5g,则溶质的成分有碳酸钠和碳酸氢钠;其物质的量分别为碳酸钠0.05mol和碳酸氢钠0.05mol;原溶液中含有NaOH的质量为6g.分析 CO2的物质的量是0.1mol,根据反应的方程式CO2+2NaOH=Na2CO3+H2O、CO2+NaOH=NaHCO3可知,如果全部是碳酸钠其物质的量为0.1mol,质量为:10.6g;如果全部是碳酸氢钠其物质的量为0.1mol,质量为8.4g,而质量为9.5g,所以生成的碳酸钠和碳酸氢钠,然后根据质量守恒和碳守恒分析解答.
解答 解:CO2的物质的量是0.1mol,根据反应的方程式CO2+2NaOH=Na2CO3+H2O、CO2+NaOH=NaHCO3可知,如果全部是碳酸钠其物质的量为0.1mol,质量为:10.6g;如果全部是碳酸氢钠其物质的量为0.1mol,质量为8.4g,而质量为9.5g,所以生成的碳酸钠和碳酸氢钠,设碳酸钠和碳酸氢钠的物质的量分别为xmol,ymol,根据质量守恒和碳守恒可知:$\left\{\begin{array}{l}{106x+84y=9.5g}\\{x+y=0.1mol}\end{array}\right.$,所以$\left\{\begin{array}{l}{x=0.05}\\{y=0.05}\end{array}\right.$,所以原溶液中含有NaOH的质量为0.05×2+0.05=0.15mol,质量为:0.15mol×40g/mol=6g,
故答案为:碳酸钠和碳酸氢钠;碳酸钠0.05mol和碳酸氢钠0.05mol;6g.
点评 本题考查混合物的计算,题目难度角度,注意把握物质的性质,判断反应的可能性以及反应的程度,根据方程式列方程计算.

练习册系列答案
 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
9.X、Y、M、N是短周期主族元素,且原子序数依次增大.已知X原子的最外层电子数是电子层数的3倍,X、M同主族,Y原子在短周期主族元素中原子半径最大.下列说法不正确的是( )
| A. | M与X的化合物对应的水化物不一定都是强酸 | |
| B. | Y2X和Y2X2中化学键类型相同,阴、阳离子的个数比相同 | |
| C. | 气态氢化物的热稳定性:M<N | |
| D. | 离子半径r:r(X2-)>r(Y+) |
10.某同学利用锌、氧化铜和稀硫酸制取铜,他设计了两套方案,
方案Ⅰ:利用锌与足量稀硫酸反应制氢气,氢气还原氧化铜;
方案Ⅱ:氧化铜溶于稀硫酸生成硫酸铜,然后用锌与硫酸铜反应制备铜.
下列关于方案Ⅰ和Ⅱ的评价不正确的是( )
方案Ⅰ:利用锌与足量稀硫酸反应制氢气,氢气还原氧化铜;
方案Ⅱ:氧化铜溶于稀硫酸生成硫酸铜,然后用锌与硫酸铜反应制备铜.
下列关于方案Ⅰ和Ⅱ的评价不正确的是( )
| A. | 方案Ⅱ比方案Ⅰ操作简便 | |
| B. | 等质量的锌,相同条件下方案Ⅰ和方案Ⅱ中制得的铜的质量相同 | |
| C. | 等质量的H2SO4参加反应,方案Ⅰ制取铜的质量比方案Ⅱ的少 | |
| D. | 为了加快锌与稀硫酸反应,可以在溶液中加入少量氧化铜 |
14.用下列实验装置完成对应的实验,能达到实验目的且合理的是( )
| A. | 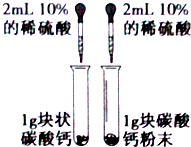 用图装置探究反应物接触面积对反应速率影响 | |
| B. | 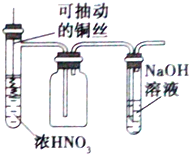 用图装置制取并收集少量的NO2气体(不考虑倒吸) | |
| C. |  用图装置制取并收集少量的氯气 | |
| D. |  用图装置制取少量乙酸乙酯 |
4.下列叙述正确的是( )
| A. | 苯与溴水混合可发生加成反应 | |
| B. | 蛋白质和油脂都属于高分子化合物,一定条件下都能水解 | |
| C. | 煤的干馏可以得到苯、甲苯和二甲苯 | |
| D. |  命名为2-甲基-3-戊烯 命名为2-甲基-3-戊烯 |

 ;水杨酸与小苏打溶液反应的化学方程式:
;水杨酸与小苏打溶液反应的化学方程式: ; 一定条件下,C与F反应的反应类型是_酯化反应.
; 一定条件下,C与F反应的反应类型是_酯化反应. .
.