题目内容
16.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )| A. | 1molC(金刚石)中含有C-C键的数目为4NA | |
| B. | 标准状况下,22.4L乙烯中含有单键的数目为4NA | |
| C. | 含0.2molH2SO4的浓硫酸与足量铜充分反应,生成SO2分子的数目为0.1NA | |
| D. | 电解精炼铜时,若阳极质量减少32g,则阴极得到电子的数目为NA |
分析 A、据n=$\frac{m}{M}$计算物质的量,每个碳原子形成四个共价键,每两个碳原子形成一个共价键;
B、求出乙烯的物质的量,然后根据1mol乙烯中含4mol单键来计算;
C、铜只能与浓硫酸反应,与稀硫酸不反应;
D、根据粗铜中含有杂质(铁)的摩尔质量比铜小,转移的电子的物质的量大于1mol分析.
解答 解:A.金刚石中,每个C形成的共价键为:$\frac{1}{2}$×4=2,则1mol金刚石形成的共价键为:1mol×2=2mol,所以1mol金刚石中含有C-C键的数目为2NA,故A错误;
B.乙烯分子中有1个C=C和4个C-H,所以乙烯分子含4条单键,标准状况下,22.4L乙烯为1mol,含有单键的数目为4NA,故B正确;
C.浓硫酸随反应进行浓度变稀后不能和铜在继续反应,硫酸不能全部反应;含0.2mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数小于0.1NA,故C错误;
D.电解精炼铜时,若阳极质量减少32g,由于阳极有铁杂质存在,铁的摩尔质量小于铜的,所以阳极减少32g,转移的电子的物质的量大于1mol,则阴极得到的电子数大于NA,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的运用以及物质的状态和结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列装置中能将电能转化为化学能的是( )
| A. |  | B. |  | C. | 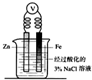 | D. | 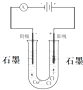 |
7.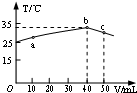 25℃时,向盛有50mL pH=2的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示.下列叙述不正确的是( )
25℃时,向盛有50mL pH=2的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示.下列叙述不正确的是( )
 25℃时,向盛有50mL pH=2的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示.下列叙述不正确的是( )
25℃时,向盛有50mL pH=2的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示.下列叙述不正确的是( )| A. | b点时酸碱恰好完全反应 | |
| B. | a→b的过程中,混合溶液中可能存在:c(A)=c(Na+) | |
| C. | HA溶液的物质的量浓度为0.01mol•L-1 | |
| D. | 25℃时,HA的电离平衡常数K约为1.43×10-3 |
4.下列关于有机物莽草酸(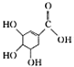 )和鞣酸(
)和鞣酸(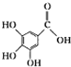 )的叙述中,正确的是( )
)的叙述中,正确的是( )
 )和鞣酸(
)和鞣酸( )的叙述中,正确的是( )
)的叙述中,正确的是( )| A. | 两种有机物中含有完全相同的官能团 | |
| B. | 两种酸都能与溴水反应,且反应类型相同 | |
| C. | 分别向两种酸中滴加三氯化铁溶液,均发生显色反应 | |
| D. | 等物质的量的两种酸与NaOH反应,消耗NaOH的量不同 |
11.金属材料的发展在人类文明发展中起着巨大的作用.下列金属中用电解方法进行冶炼的是( )
| A. | 铝 | B. | 铜 | C. | 银 | D. | 铁 |
1.化学与资源、环境、生活关系密切,下列说法不正确的是( )
| A. | 将镁块与钢铁输水管相连,可防止钢铁腐蚀 | |
| B. | 推广使用新能源,可以减少二氧化碳等温室气体的排放 | |
| C. | 焊锡中加铅的目的是降低熔点 | |
| D. | 石油是混合物,其分馏产品汽油为纯净物 |
8.短周期元素X、Y、Z、W的原子序数逐渐增大,其中X原子的电子数与电子层数相等,Z为短周期中金属性最强的元素,Y与X、Y与Z均能形成原子个数比为1:1和1:2的两种化合物,Y和W同主族.下列说法正确的是( )
| A. | Y与Z形成的两种化合物中所含化学键类型完全相同 | |
| B. | 化合物X2W比化合物X2Y稳定 | |
| C. | Y、Z、W三种元素形成的化合物的水溶液一定呈中性 | |
| D. | 原子半径:r(Z)>r(W)>r(Y)>r(X) |
3.下列微粒之间能形成离子键的是( )
①K+
②质量数为19,中子数为10的原子
③第三周期半径最大的原子(Ar除外)
④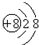
①K+
②质量数为19,中子数为10的原子
③第三周期半径最大的原子(Ar除外)
④
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
4.甲、乙两种有机物的最简式均为CH2O.下列叙述一定正确的是( )
| A. | 甲乙互为同系物 | |
| B. | 甲乙互为同分异构体 | |
| C. | 等物质的量的甲、乙完全燃烧所耗O2的物质的量相等 | |
| D. | 甲、乙分别充分燃烧,产生CO2和H2O的物质的量之比均为1:1 |