题目内容
11.金属材料的发展在人类文明发展中起着巨大的作用.下列金属中用电解方法进行冶炼的是( )| A. | 铝 | B. | 铜 | C. | 银 | D. | 铁 |
分析 依据金属活泼性,一般活泼的金属用电解法,较活泼的金属用热还原法,不活泼的金属例如汞、银等用热分解法,据此解答.
解答 解:A.铝性质活泼,用电解氧化铝方法冶炼,故A选;
B.Cu用热还原法冶炼,故B不选;
C.Ag用热分解法冶炼,故C不选;
D.Fe用热还原法冶炼,故D不选;
故选:A.
点评 本题考查金属冶炼的一般方法和原理,根据金属的活泼性采用相应的冶炼方法,难度不大,注意相关知识的积累.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
1.已知H3PO4为弱酸,常温下NaH2PO4溶液的pH小于7.下列关于常温下0.10mol•L-1的NaH2PO4溶液的说法正确的是( )
| A. | c(Na+)=c(H2PO4-)+c(HPO42-)+C(H3PO4) | |
| B. | c(Na+)+c(H+)=c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-) | |
| C. | 温度升高,c(H2PO4-)增大 | |
| D. | 加水稀释后,m(H+)与m(OH-)的乘积不变 |
2.下列有关说法中正确的是( )
| A. | 100g98%的浓H2SO4中所含的氧原子数为4NA(NA为阿伏伽德罗常数,下同) | |
| B. | 3.1g白磷晶体中含有的P-P键数是0.6NA | |
| C. | 向Ca(HCO3)2溶液中加入Ca(OH)2溶液至过量:Ca2++2HCO3-+2OH-═CaCO3↓+CO${\;}_{3}^{2-}$+2H2O | |
| D. | 冰水中常会形成(H2O)x(x≥1)分子,原因是存在氢键 |
19.乙烯的相关转化关系如图.下列说法正确的是( )
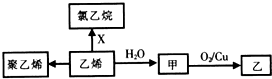

| A. | 聚乙烯是纯净物 | B. | X为C12 | ||
| C. | CH3OCH3与甲互为同分异构体 | D. | 甲→乙反应类型为取代反应 |
6.表中的W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )
| X | Y | ||
| W | Z |
| A. | 最高价氧化物对应水化物的酸性:Z>X>W | |
| B. | 最低价氢化物的沸点:Z>Y>X | |
| C. | 原子半径:W>X>Y>Z | |
| D. | 由X、Y和氢三种元素只能形成含有共价键的化合物 |
16.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1molC(金刚石)中含有C-C键的数目为4NA | |
| B. | 标准状况下,22.4L乙烯中含有单键的数目为4NA | |
| C. | 含0.2molH2SO4的浓硫酸与足量铜充分反应,生成SO2分子的数目为0.1NA | |
| D. | 电解精炼铜时,若阳极质量减少32g,则阴极得到电子的数目为NA |
3.用下列实验装置进行的实验中,不能达到相应实验目的是( )
| A. | 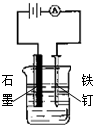 装置:防止铁钉生锈 | B. |  装置:可制得金属锰 | ||
| C. |  装置:实验室制取乙酸乙酯 | D. | 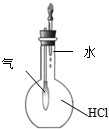 装置:验证HCl气体在水中的溶解性 |
20.下列说法正确的是( )
| A. | 蔗糖、淀粉、油脂及其水解产物均为非电解质 | |
| B. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| C. | 用新制Cu(OH)2悬浊液可以鉴别乙酸、乙醇和葡萄糖 | |
| D. | 分子组成为CH4或C2H6O的有机物不存在同分异构现象 |
19.下列有关实验叙述正确的是( )
| A. | 甲烷的取代反应试验:取一支大试管,用排饱和食盐水的方法收集体积比约为1:4的甲烷与氯气,用橡皮塞塞好管口,放在日光直射的地方 | |
| B. | 乙烯与溴的加成反应,将过量的乙烯通入盛有溴水的试管中,观察试管内溶液颜色变化 | |
| C. | 将混合气体通过盛有酸性高锰酸钾溶液的洗气瓶,既可以鉴别甲烷和乙烯,又可以除去甲烷中混有的少量乙烯 | |
| D. | 新制Cu(OH)2悬浊液的配置:在试管中加入2mLCuSO4溶液,滴加5%NaOH溶液4~5滴,然后混合均匀 |