题目内容
7.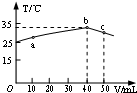 25℃时,向盛有50mL pH=2的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示.下列叙述不正确的是( )
25℃时,向盛有50mL pH=2的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示.下列叙述不正确的是( )| A. | b点时酸碱恰好完全反应 | |
| B. | a→b的过程中,混合溶液中可能存在:c(A)=c(Na+) | |
| C. | HA溶液的物质的量浓度为0.01mol•L-1 | |
| D. | 25℃时,HA的电离平衡常数K约为1.43×10-3 |
分析 A.恰好中和时混合溶液温度最高,结合图象曲线变化判断,
B.NaA呈碱性,HA呈酸性,a→b的过程中,混合溶液中可能呈中性,依据电荷守恒分析;
C.b点前后完全反应,此时消耗氢氧化钠0.004mol,计算氢氧化钠物质的量和酸物质的量相同计算得出HA的浓度;
D.根据电离平衡常数K=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$进行计算和判断.
解答 解:A.恰好中和时混合溶液温度最高,根据图象可知b点温度最高,则b点酸碱恰好完全反应,故A正确;
B.NaA呈碱性,HA呈酸性,a→b的过程中,混合溶液中可能呈中性,则:c(A-)=c(Na+),故B正确;
C.恰好中和时混合溶液温度最高,即b点,此时消耗氢氧化钠=0.04L×0.1mol/L=0.004mol,得出50mlHA的浓度=$\frac{0.004mol}{0.05L}$=0.08mol/L,故C错误;
D.根据计算可知,pH=2的HA溶液的浓度为0.08mol/L,pH=2的溶液中氢离子浓度为0.01mol/L,则溶液中c(HA)=0.08mol/L-0.01mol/L,所以电离平衡常数K=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$=$\frac{0.01mol/L×0.01mol/L}{0.08mol/L-0.01mol/L}$=1.43×10-3,故D正确;
故选C.
点评 本题考查酸碱混合的定性判断,题目难度中等,试题侧重考查学生的分析、理解问题的能力及计算能力,正确分析图象曲线变化为解答根据,注意掌握酸碱混合定性判断的方法.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
17.下列与实验有关的叙述不正确的是( )
| A. | 液溴保存时应加少量水并盛放在用玻璃塞塞紧的试剂瓶中 | |
| B. | 某气体通入品红溶液褪色,加热溶液又变红,该气体为SO2 | |
| C. | 配制硫酸亚铁溶液,可将绿矾晶体溶于蒸馏水并加入一定量的稀硫酸和铁屑 | |
| D. | 某溶液中加盐酸产生使澄清石灰水变浑浊的无色气体,则该溶液一定含CO32- |
15.下列说法正确的是( )
| A. | 等质量的乙酸、葡萄糖与淀粉完全燃烧时消耗氧气的质量相等 | |
| B. | 醇、醛和羧酸都溶于水,烃与酯的密度都小于1g/cm3 | |
| C. | 豆浆中富含大豆蛋白,煮沸后蛋白质水解成了氨基酸 | |
| D. | 某烯烃(最简式为CH2)与H2加成产物为2,3-二甲基丁烷,则该烯烃可能有2种结构 |
2.下列有关说法中正确的是( )
| A. | 100g98%的浓H2SO4中所含的氧原子数为4NA(NA为阿伏伽德罗常数,下同) | |
| B. | 3.1g白磷晶体中含有的P-P键数是0.6NA | |
| C. | 向Ca(HCO3)2溶液中加入Ca(OH)2溶液至过量:Ca2++2HCO3-+2OH-═CaCO3↓+CO${\;}_{3}^{2-}$+2H2O | |
| D. | 冰水中常会形成(H2O)x(x≥1)分子,原因是存在氢键 |
12.下列说法正确的是( )
| A. | 淀粉、油脂和蛋白质都是高分子化合物 | |
| B. | 丁烷(C4H10)和二氯甲烷都存在同分异构体 | |
| C. | “地沟油”的主要成分是油脂,其类别与煤油不同 | |
| D. | 煤中含有煤焦油及多种化工原料,可通过煤的干馏获得 |
19.乙烯的相关转化关系如图.下列说法正确的是( )
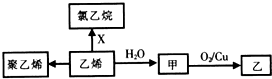

| A. | 聚乙烯是纯净物 | B. | X为C12 | ||
| C. | CH3OCH3与甲互为同分异构体 | D. | 甲→乙反应类型为取代反应 |
16.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1molC(金刚石)中含有C-C键的数目为4NA | |
| B. | 标准状况下,22.4L乙烯中含有单键的数目为4NA | |
| C. | 含0.2molH2SO4的浓硫酸与足量铜充分反应,生成SO2分子的数目为0.1NA | |
| D. | 电解精炼铜时,若阳极质量减少32g,则阴极得到电子的数目为NA |

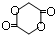 .
.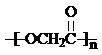 +nH2O,
+nH2O,