题目内容
3.下列微粒之间能形成离子键的是( )①K+
②质量数为19,中子数为10的原子
③第三周期半径最大的原子(Ar除外)
④
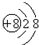
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
分析 活泼金属和活泼非金属元素之间易形成离子键,同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,据此分析解答.
解答 解:①为钾离子;
②中质子数=19-10=9,为F原子;
③第三周期原子半径最大的原子是Na原子;
④该微粒为O 2-,
活泼金属和活泼非金属元素之间易形成离子键,同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,所以能形成离子键的是②③,
故选B.
点评 本题以离子键的形成为载体考查知识点,明确离子键、共价键的区别及形成条件是解本题关键,题目难度不大.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目
15.下列说法正确的是( )
| A. | 等质量的乙酸、葡萄糖与淀粉完全燃烧时消耗氧气的质量相等 | |
| B. | 醇、醛和羧酸都溶于水,烃与酯的密度都小于1g/cm3 | |
| C. | 豆浆中富含大豆蛋白,煮沸后蛋白质水解成了氨基酸 | |
| D. | 某烯烃(最简式为CH2)与H2加成产物为2,3-二甲基丁烷,则该烯烃可能有2种结构 |
16.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1molC(金刚石)中含有C-C键的数目为4NA | |
| B. | 标准状况下,22.4L乙烯中含有单键的数目为4NA | |
| C. | 含0.2molH2SO4的浓硫酸与足量铜充分反应,生成SO2分子的数目为0.1NA | |
| D. | 电解精炼铜时,若阳极质量减少32g,则阴极得到电子的数目为NA |
13.下列实验操作、现象和结论均正确的是( )
| 实验操作 | 现象 | 解释 | |
| A | 常温下,用pH计测定NaHCO3溶液的pH | pH=8.5 | HCO3-的水解程度大于电离程度 |
| B | 向一定量的浓硫酸中加入过量的锌粒,微热至反应结束 | 产生气泡 | 该气体成分仅为SO2 |
| C | 往盛有少量水的两支试管中分别加入Na和Na2O2 | 固体溶解,产生气泡 | 两个反应中水都作氧化剂 |
| D | 往滴有KSCN的FeCl2溶液中通入少量Cl2 | 溶液由浅绿色变血红色 | 氧化性:Cl2>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
20.下列说法正确的是( )
| A. | 蔗糖、淀粉、油脂及其水解产物均为非电解质 | |
| B. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| C. | 用新制Cu(OH)2悬浊液可以鉴别乙酸、乙醇和葡萄糖 | |
| D. | 分子组成为CH4或C2H6O的有机物不存在同分异构现象 |
12.下列与含氯化合物有关的说法正确的是( )
| A. | HClO是弱酸,所以NaClO是弱电解质 | |
| B. | 电解NaCl 溶液得到22.4L H2,理论上需要转移2NA个电子(NA阿伏伽德罗常数) | |
| C. | HCl 溶液和NaCl溶液均通过离子导电,所以HCl 和NaCl均是离子化合物 | |
| D. | 向沸水中逐滴加入少量饱和FeCl3 溶液,可制得Fe(OH)3胶体 |
13.食品添加剂关系到大家健康,下列物质中的添加剂作用不正确的是( )
| A. | 、 防治高血压 | B. |  防治缺铁性贫血 | ||
| C. |  做甜味剂 | D. | 、 火腿中加有防腐剂亚硝酸钠 |
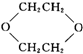 ,是一种常见的有机溶剂,它可以通过下列三步反应制得:
,是一种常见的有机溶剂,它可以通过下列三步反应制得:
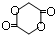 .
.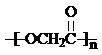 +nH2O,
+nH2O,