题目内容
8.短周期元素X、Y、Z、W的原子序数逐渐增大,其中X原子的电子数与电子层数相等,Z为短周期中金属性最强的元素,Y与X、Y与Z均能形成原子个数比为1:1和1:2的两种化合物,Y和W同主族.下列说法正确的是( )| A. | Y与Z形成的两种化合物中所含化学键类型完全相同 | |
| B. | 化合物X2W比化合物X2Y稳定 | |
| C. | Y、Z、W三种元素形成的化合物的水溶液一定呈中性 | |
| D. | 原子半径:r(Z)>r(W)>r(Y)>r(X) |
分析 短周期元素X、Y、Z、W的原子序数逐渐增大,其中X原子的电子数与电子层数相等,则X为H元素;Z为短周期中金属性最强的元素,则Z为Na;Y与X、Y与Z均能形成原子个数比为1:1和1:2的两种化合物,则Y为O元素,形成的化合物为H2O2、H2O及Na2O2、Na2O,Y和W同主族,则W为S元素,据此解答.
解答 解:短周期元素X、Y、Z、W的原子序数逐渐增大,其中X原子的电子数与电子层数相等,则X为H元素;Z为短周期中金属性最强的元素,则Z为Na;Y与X、Y与Z均能形成原子个数比为1:1和1:2的两种化合物,则Y为O元素,形成的化合物为H2O2、H2O及Na2O2、Na2O,Y和W同主族,则W为S元素.
A.Y与Z形成的两种化合物为Na2O2、Na2O,前者含有离子键、共价键,后者只含有离子键,故A错误;
B.化合物X2W为H2S、化合物X2Y为H2O,由于非金属性O>S,故稳定性H2O>H2S,故B错误;
C.Y、Z、W三种元素形成的化合物为硫酸钠、亚硫酸钠等,硫酸钠溶液呈中性,但亚硫酸钠溶液呈碱性,故C错误;
D.所用元素中H原子半径最小,同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:r(Z)>r(W)>r(Y)>r(X),故D正确,
故选D.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意对元素周期律的理解掌握,需要学生熟练掌握常见元素化合物的结构与性质,难度中等.

练习册系列答案
相关题目
19.乙烯的相关转化关系如图.下列说法正确的是( )
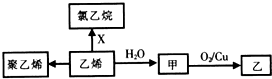

| A. | 聚乙烯是纯净物 | B. | X为C12 | ||
| C. | CH3OCH3与甲互为同分异构体 | D. | 甲→乙反应类型为取代反应 |
16.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1molC(金刚石)中含有C-C键的数目为4NA | |
| B. | 标准状况下,22.4L乙烯中含有单键的数目为4NA | |
| C. | 含0.2molH2SO4的浓硫酸与足量铜充分反应,生成SO2分子的数目为0.1NA | |
| D. | 电解精炼铜时,若阳极质量减少32g,则阴极得到电子的数目为NA |
3.用下列实验装置进行的实验中,不能达到相应实验目的是( )
| A. | 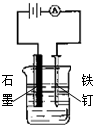 装置:防止铁钉生锈 | B. |  装置:可制得金属锰 | ||
| C. |  装置:实验室制取乙酸乙酯 | D. | 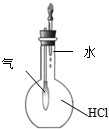 装置:验证HCl气体在水中的溶解性 |
13.下列实验操作、现象和结论均正确的是( )
| 实验操作 | 现象 | 解释 | |
| A | 常温下,用pH计测定NaHCO3溶液的pH | pH=8.5 | HCO3-的水解程度大于电离程度 |
| B | 向一定量的浓硫酸中加入过量的锌粒,微热至反应结束 | 产生气泡 | 该气体成分仅为SO2 |
| C | 往盛有少量水的两支试管中分别加入Na和Na2O2 | 固体溶解,产生气泡 | 两个反应中水都作氧化剂 |
| D | 往滴有KSCN的FeCl2溶液中通入少量Cl2 | 溶液由浅绿色变血红色 | 氧化性:Cl2>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
20.下列说法正确的是( )
| A. | 蔗糖、淀粉、油脂及其水解产物均为非电解质 | |
| B. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| C. | 用新制Cu(OH)2悬浊液可以鉴别乙酸、乙醇和葡萄糖 | |
| D. | 分子组成为CH4或C2H6O的有机物不存在同分异构现象 |
16.为了提纯如表所列物质(括号内为杂质),有关除杂试剂和分离方法的选择均正确的是( )
| 编 号 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴水 | 分液 |
| B | 淀粉溶液(NaCl) | 水 | 过滤 |
| C | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| D | 苯(苯酚) | NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |

 .
. +nH2O,
+nH2O,