题目内容
4.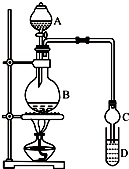 乙酸乙酯是一种用途广泛的精细化工产品.某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:已知:
乙酸乙酯是一种用途广泛的精细化工产品.某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:已知:①氯化钙可与乙醇形成CaCl2•6C2H5OH
②2CH3CH2OH$→_{140℃}^{浓H_{2}SO_{4}}$CH3CH2OCH2CH3+H2O
I.制备过程
装置如图所示,A中放有浓硫酸,B中放有9.5mL无水乙醇和6mL冰醋酸,D中放有饱和碳酸钠溶液.
(1)写出乙酸与乙醇发生酯化反应的化学方程式CH3COOH+CH3CH2OH
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.(2)实验过程中滴加大约3mL浓硫酸,B的容积最合适的是B(填入正确选项前的字母).
A.25mL B.50mL C.250mL D.500mL
(3)球形干燥管的主要作用是防倒吸.
(4)预先向饱和Na2CO3溶液中滴加几滴酚酞试液,目的是便于观察液体分层.
Ⅱ.提纯方法:
①将D中混合液转入分液漏斗进行分液.
②有机层用5mL饱和食盐水洗涤,再用5mL饱和氯化钙溶液洗涤,最后用水洗涤.有机层倒入一干燥的烧瓶中,用无水硫酸镁干燥,得粗产物.
③将粗产物蒸馏,收集77.1℃的馏分,得到纯净干燥的乙酸乙酯.
(5)第①步分液时,选用的两种玻璃仪器的名称分别是分液漏斗、烧杯.
分析 (1)酯化反应的本质为酸脱羟基,醇脱氢,乙醇、乙酸反应生成乙酸乙酯和水,且为可逆反应;
(2)烧瓶中液体的体积不超过烧瓶容积的$\frac{2}{3}$且不少于$\frac{1}{3}$;
(3)根据粗产品乙酸乙酯、乙酸和乙醇的混合物中各自的性质,以及加热不充分也能产生倒吸进行解答;
(4)饱和碳酸钠溶液呈碱性,酚酞遇见变红色,有利于观察颜色;
(5)根据分液操作用到的仪器回答.
解答 解:(1)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应方程式为:CH3COOH+CH3CH2OH CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
故答案为:CH3COOH+CH3CH2OH CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
(2)烧瓶内的液体体积约为3ml+9.5ml+6ml=18.5mol,烧瓶中液体的体积不超过烧瓶容积的$\frac{2}{3}$且不少于$\frac{1}{3}$,因此50ml符合,
故答案为:B;
(3)乙酸乙酯中混有乙醇和乙酸,二者易溶于水而产生倒吸,加热不充分也能产生倒吸,用球形干燥管,除起冷凝作用外,球形干燥管球形部分由于容积较大,也能起到防止倒吸的作用,
故答案为:防倒吸;
(4)在饱和碳酸钠溶液中,乙酸乙酯的溶解度较低,出现分层,饱和碳酸钠溶液呈碱性,酚酞遇见变红色,有利于观察液体分层,
故答案为:便于观察液体分层;
(5)分液操作中用到的主要仪器是分液漏斗,烧杯作为盛放分层液体的容器,
故答案为:分液漏斗;烧杯.
点评 本题考查了乙酸乙酯的制备,题目难度中等,注意理解饱和碳酸钠溶液的作用以及酯化反应的机理,试题培养了学生分析、理解能力及灵活应用所学知识解决实际问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
14.下列无色溶液中的离子能大量共存的是( )
| A. | K+、Na+、MnO4-、SO42- | B. | Al3+、Cl-、SO42-、AlO2- | ||
| C. | Na+、Ba2+、Cl-、Br- | D. | Fe3+、NH4+、SCN-、HCO3- |
15.下列实验不能获得成功的是( )
| A. | 用半透膜可除去蛋白质溶液中的NaCl | |
| B. | 用灼烧的方法检验是毛线还是棉线 | |
| C. | 为证明硬脂酸有酸性,取稀NaOH溶液(滴有酚酞)加入硬脂酸并加热 | |
| D. | 欲证明放入硫酸溶液中的纤维素加热已发生水解,可向所得溶液加入银氨溶液,放在水浴中 |
13.苯环结构中不存在C-C单键和C=C双键的交替结构,可以作为证据的事实( )
①苯不能使酸性KMnO4溶液褪色;
②苯环中碳碳键的键长均相等;
③苯能在催化剂存在和加热的条件下氢化生成环己烷;
④邻二甲苯只有一种结构;
⑤苯在FeBr3存在下同液溴发生取代反应,但不因化学反应而使溴水褪色.
①苯不能使酸性KMnO4溶液褪色;
②苯环中碳碳键的键长均相等;
③苯能在催化剂存在和加热的条件下氢化生成环己烷;
④邻二甲苯只有一种结构;
⑤苯在FeBr3存在下同液溴发生取代反应,但不因化学反应而使溴水褪色.
| A. | ②③④⑤ | B. | ①③④⑤ | C. | ①②④⑤ | D. | ①②③④ |
1.实验室常用强氧化剂(如KMnO4、KClO3、MnO2等)氧化浓盐酸的方法来制备氯气.某研究性学习小组欲探究用Na2O2与浓盐酸制备并检验氯气,供选用的实验试剂及装置如下(部分导管、蒸馏水略去).
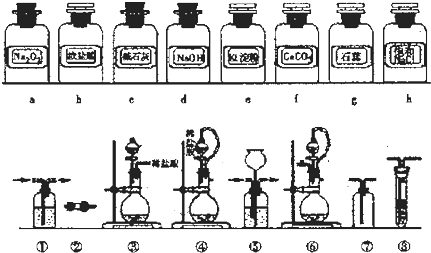
I.写出制取氯气的化学方程式或离子方程式:
①MnO2与浓盐酸制取氯气的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
②Na2 O2与浓盐酸制备氯气的化学方程式Na2O2+4HCl=2NaCl+Cl2↑+2H2O.
Ⅱ.完成用Na2O2与浓盐酸制备氯气的有关问题:
(1)下列装置组合最合理的是D(填序号,需考虑实验结束撤除装置时残留有害气体的处理).
(2)尾气经处理后仍有较多气体排出,其主要原因用化学方程式表示为2Na2O2+2H2O=4NaOH+O2↑(或4Na2O2+4HCl=4NaCl+2H2O+O2↑)
(3)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:
①Na2O2能与水反应,会使原料的利用率降低,
②双氧水比Na2O2更经济.
(4)你是否同意将Na2O2与浓盐酸的反应作为实验室制备氯气的方法之一?否(填“是”或“否”);理由是产物不纯且难以分离.

I.写出制取氯气的化学方程式或离子方程式:
①MnO2与浓盐酸制取氯气的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
②Na2 O2与浓盐酸制备氯气的化学方程式Na2O2+4HCl=2NaCl+Cl2↑+2H2O.
Ⅱ.完成用Na2O2与浓盐酸制备氯气的有关问题:
(1)下列装置组合最合理的是D(填序号,需考虑实验结束撤除装置时残留有害气体的处理).
| 组合 | 制备装置 | 净化装置 | 检验装置/-试剂 | 尾气处理装置 |
| A | ③ | ② | ⑦/e | ⑤ |
| B | ③⑥ | ① | ⑧/g | ① |
| C | ④ | ① | ⑤/e | ② |
| D | ④⑥ | ⑤ | ⑧/g | ① |
(3)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:
①Na2O2能与水反应,会使原料的利用率降低,
②双氧水比Na2O2更经济.
(4)你是否同意将Na2O2与浓盐酸的反应作为实验室制备氯气的方法之一?否(填“是”或“否”);理由是产物不纯且难以分离.
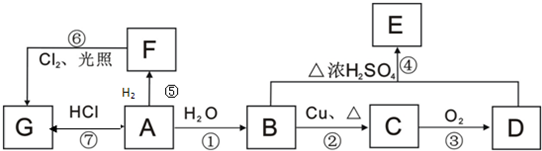
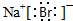 .
.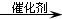
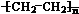 .A和水在一定条件下反应生成B,B为生活中常见的有机物,B可与另一种生活中常见有机物在一定条件下反应生成有香味的物质C,写出生成C的化学方程式
.A和水在一定条件下反应生成B,B为生活中常见的有机物,B可与另一种生活中常见有机物在一定条件下反应生成有香味的物质C,写出生成C的化学方程式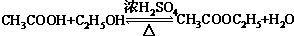 .比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射氯乙烷(沸点12.27℃)进行局部冷冻麻醉应急处理.乙烯和氯化氢在一定条件下制得氯乙烷的化学反应方程式是(有机物用结构简式表示)CH2=CH2+HC1
.比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射氯乙烷(沸点12.27℃)进行局部冷冻麻醉应急处理.乙烯和氯化氢在一定条件下制得氯乙烷的化学反应方程式是(有机物用结构简式表示)CH2=CH2+HC1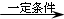 CH3CH2C1,该反应类型是加成反应.
CH3CH2C1,该反应类型是加成反应.
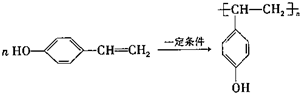 .
.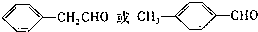 等.
等.