题目内容
19.空气吹出法是最早工业上海水提溴的方法,适合从低浓度含溴溶液提取溴.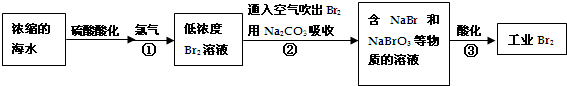
(1)Br2单质的颜色为深红棕色,NaBr的电子式是
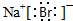 .
.(2)反应①是将Br-转化为Br2,则反应①的离子方程式是Cl2+2Br-=Br2+2Cl-.
(3)通入空气吹出Br2,并用Na2CO3吸收的目的是富集溴.
(4)反应③的离子方程式是5Br-+6H++BrO3-═3Br2+3H2O,每生成3mol Br2,转移电子的物质的量是5mol.
(5)为了除去工业Br2中微量的Cl2,可向工业Br2中b(填字母).
a.通入HBr b.加入NaBr溶液 c.加入Na2CO3溶液 d.加入Na2SO3溶液.
分析 由流程可知,浓缩后增大溴离子的浓度,与氯气发生2Br-+C12=Br2+2Cl-,用空气将溴吹出,用纯碱溶液吸收,从而达到富集溴,②中发生3Br2+3Na2CO3═5NaBr+3CO2+NaBrO3,③中发生5Br-+6H++BrO3-═3Br2+3H2O,以此来解答.
解答 解:由流程可知,浓缩后增大溴离子的浓度,与氯气发生2Br-+C12=Br2+2Cl-,用空气将溴吹出,用纯碱溶液吸收,从而达到富集溴,②中发生3Br2+3Na2CO3═5NaBr+3CO2+NaBrO3,③中发生5Br-+6H++BrO3-═3Br2+3H2O,
(1)Br2单质的颜色为深红棕色,NaBr为离子化合物,其电子式为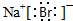 ,故答案为:深红棕色;
,故答案为:深红棕色;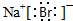 ;
;
(2)反应①是氯气将Br-转化为Br2,反应①的离子方程式是Cl2+2Br-=Br2+2Cl-,故答案为:Cl2+2Br-=Br2+2Cl-;
(3)由上述分析可知,用Na2CO3吸收的目的是富集溴,故答案为:富集溴;
(4)反应③的离子方程式为5Br-+6H++BrO3-═3Br2+3H2O,由NaBrO3中溴元素的化合价降低为5-0=5可知,每生成3mol Br2,转移电子的物质的量是5mol,
故答案为:5Br-+6H++BrO3-═3Br2+3H2O;5;
(5)除去工业Br2中微量的Cl2,不能选碳酸钠、亚硫酸钠,因为它们均与溴、氯气反应,a会引入杂质,只有b中NaBr溶液与Cl2反应,然后分液可除去Cl2,
故答案为:b.
点评 本题考查海水资源的综合利用,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握相关物质的性质,为解答该题的关键,题目难度不大,注意(5)中除杂不能引入新杂质,且易于分离.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
9.实验室制备氯气的装置如图.图中涉及气体发生、除杂、干燥、收集、尾气处理装置,其中错误的是( )


| A. | ① | B. | ② | C. | ③ | D. | ④ |
10.下列说法或表示法正确的是( )
| A. | 在稀溶液中:H++OH-═H2O;△H=-57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量等于57.3kJ | |
| B. | 由4P(s,红磷)═P4(s,白磷):△H>0可知,白磷的热稳定性比红磷大 | |
| C. | 已知2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ•mol-1,则H2的燃烧热等于241.8 kJ•mol-1 | |
| D. | 己知:S(g)+O2(g)═SO2(g);△H1及S(s)+O2(g)═SO2(g):△H2,则△H1<△H2 |
7.下列有关同分异构体数目的叙述中,正确的是( )
| A. | 甲苯苯环上的一个氢原子被含4个碳原子的烷基取代,所得产物有12种 | |
| B. | 等物质的量的氯气与乙烷在光照条件下反应得到9种产物 | |
| C. | 已知二氯苯有3种同分异构体,则四氯苯的同分异构体的数目为6种 | |
| D. | 苯乙烯和氢气完全加成的产物的一溴取代物有5种 |
14.下列叙述不正确的是( )
| A. | 热的纯碱溶液可以去除餐具上的油污 | |
| B. | 过氧化钠可用做呼吸面具的供氧剂 | |
| C. | 工业上用电解饱和食盐水获得金属钠 | |
| D. | 氢氧化铝是医用的胃酸中和剂的一种 |
11.下列离子方程式正确的是( )
| A. | 乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| B. | 乙醇与钠反应:2CH3CH2O-+2H++2Na→2CH3CH2ONa+H2↑ | |
| C. | 苯酚钠溶液中通入二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| D. | 苯酚溶液中加入溴水: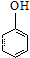 +3B2→ +3B2→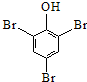 ↓+3H++3Br- ↓+3H++3Br- |
8.下面有机物的同系物中,完全燃烧产生的水和二氧化碳的物质的量之比恒定的是①饱和一元醇②饱和一元醛③饱和一元羧酸④饱和一元醇和饱和一元羧酸生成的酯⑤乙炔的同系物⑥苯的同系物( )
| A. | ①④ | B. | ②③④⑤⑥ | C. | ②③ | D. | ②③④ |
16.下列原子轨道能量最大的是( )
| A. | 3d | B. | 2p | C. | 5f | D. | 4s |
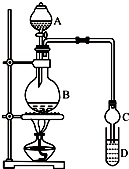 乙酸乙酯是一种用途广泛的精细化工产品.某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:已知:
乙酸乙酯是一种用途广泛的精细化工产品.某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:已知: CH3COOC2H5+H2O.
CH3COOC2H5+H2O.