题目内容
14.下列无色溶液中的离子能大量共存的是( )| A. | K+、Na+、MnO4-、SO42- | B. | Al3+、Cl-、SO42-、AlO2- | ||
| C. | Na+、Ba2+、Cl-、Br- | D. | Fe3+、NH4+、SCN-、HCO3- |
分析 无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.高锰酸根离子为有色离子,不满足溶液无色的条件;
B.铝离子与偏铝酸根离子发生双水解反应生成氢氧化铝沉淀;
C.四种离子之间不反应,都是无色离子;
D.铁离子为有色离子,铁离子与硫氰根离子、碳酸氢根离子反应.
解答 解:溶液无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.MnO4-为有色离子,不满足溶液无色的要求,故A错误;
B.Al3+、AlO2-发生双水解反应生成氢氧化铝,在溶液中不能大量共存,故B错误;
C.Na+、Ba2+、Cl-、Br-之间不发生反应,都是无色离子,在溶液中能够大量共存,故C正确;
D.Fe3+、SCN-生成Fe(SCN)3,Fe3+为有色离子,Fe3+与HCO3-发生双水解反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存,而高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,溶液:溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在.

练习册系列答案
 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
4.下列有关化学知识的叙述中正确的是( )
| A. | C、S、N所形成的氧化物均为酸性氧化物 | |
| B. | “水滴石穿”是因为CaCO3与CO2、水发生了化学反应 | |
| C. | 常用作水处理剂的KAl(SO4)2和漂白粉都是强电解质 | |
| D. | 232Th 转变成233U是化学变化,233U和235U的化学性质几乎相同 |
5.定量分析中可用AgNO3溶液滴定Cl-溶液,加入K2CrO4为指示剂,达到滴定终点时溶液体积为50mL,c(Cl-)=10-5 mol•L-1,AgNO3与CrO42-生成砖红色的Ag2CrO4沉淀.已知Ksp(AgCl)=1.77×10-10,Ksp(AgI)=8.51×10-17,Ksp(Ag2CrO4)=1.12×10-12,根据以上实验操作和有关数据,下列说法正确的是( )
| A. | 常温下,向含AgCl固体的AgCl溶液中加入NaCl固体,AgCl沉淀的量不变 | |
| B. | 滴定终点时,溶液中CrO42-的浓度约为3.6×10-3 mol•L-1 | |
| C. | 向0.1moL/L AgNO3溶液中滴加3-5滴0.1moL/L NaCl溶液生成AgCl沉淀,再滴加KI溶液,生成AgI沉淀,能够说明Ksp(AgI)<Ksp(AgCl) | |
| D. | 可用0.1 mol•L-1的KI溶液代替K2CrO4做指示剂 |
2.下列有机物中,完全燃烧时生成的二氧化碳与水的物质的量之比为2:1的是( )
| A. | 乙烷 | B. | 乙烯 | C. | 乙炔 | D. | 乙醇 |
9.实验室制备氯气的装置如图.图中涉及气体发生、除杂、干燥、收集、尾气处理装置,其中错误的是( )


| A. | ① | B. | ② | C. | ③ | D. | ④ |
19.在下列各溶液中,一定能大量共存的一组离子是( )
| A. | 含有AlO2-的溶液中:Na+、Al3+、NO3-、Cl- | |
| B. | 使淀粉碘化钾变蓝的溶液中:K+、HCO3-、S2-、SO42- | |
| C. | 能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、Na+ | |
| D. | 透明溶液中:Na+、MnO4-、Na+、SO42- |
6.据报道,已发现了第114号元素.下列关于其推测不正确的是( )
| A. | 它有+2,+3,+4价 | B. | 其晶体有良好的导电性 | ||
| C. | 其原子最外层上有4个电子 | D. | 该元素位于第七周期ⅣA族 |
3.下列离子方程式书写正确的是( )
| A. | 硫氢化钠的水解:HS-+H2O═S2-+H3O+ | |
| B. | Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 钢铁发生吸氧腐蚀的负极反应式:O2+4e-+2H2O═4OH- | |
| D. | 碳酸氢铵溶液中滴入少量烧碱溶液:HCO3-+OH-═CO32-+H2O |
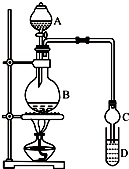 乙酸乙酯是一种用途广泛的精细化工产品.某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:已知:
乙酸乙酯是一种用途广泛的精细化工产品.某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:已知: CH3COOC2H5+H2O.
CH3COOC2H5+H2O.