题目内容
8.下列有关实验的叙述不正确的是( )| A. | 某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 | |
| B. | 碘水与碘化钾淀粉试纸作用出现蓝色,说明碘具有氧化性 | |
| C. | 往饱和Na2CO3溶液中通入CO2有固体析出,说明NaHCO3溶解度小于Na2CO3 | |
| D. | 同温下,等物质的量浓度的Al2(SO4)3比MgSO4溶液的pH小,说明镁比铝的金属性强 |
分析 A.碱性溶液能使湿润的红色石蕊试纸变蓝;
B.碘水含碘单质,淀粉遇碘单质变蓝;
C.饱和Na2CO3溶液中通入CO2有固体析出,析出固体为溶解度小的碳酸氢钠;
D.等物质的量浓度的Al2(SO4)3比MgSO4溶液的pH小,可知Al2(SO4)3水解程度大,则可知氢氧化铝的碱性弱.
解答 解:A.某气体能使湿润的红色石蕊试纸变蓝,则气体的水溶液显碱性,如气体为氨气,故A正确;
B.碘水含碘单质,淀粉遇碘单质变蓝,则碘水与碘化钾淀粉试纸作用出现蓝色,不能说明碘的氧化性,故B错误;
C.饱和Na2CO3溶液中通入CO2有固体析出,析出固体为溶解度小的碳酸氢钠,可知NaHCO3溶解度小于Na2CO3,故C正确;
D.等物质的量浓度的Al2(SO4)3比MgSO4溶液的pH小,可知Al2(SO4)3水解程度大,则可知氢氧化铝的碱性比氢氧化镁的弱,则金属性Mg>Al,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的性质及检验、盐类水解及金属性比较、溶解度等,把握反应原理、物质的性质为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
18.几种短周期元素的原子半径及主要化合价如下表,下列叙述不正确的是( )
| 元素代号 | X | Y | Z | W | T |
| 原子半径/nm | 0.186 | 0.143 | 0.102 | 0.074 | 0.071 |
| 主要化合价 | +1 | +3 | +6、-2 | -2 | -1、无正价 |
| A. | X与W形成的化合物中都只含离子键 | |
| B. | Z的氢化物与T的单质具有相同的核外电子数 | |
| C. | Y、X的最高价氧化物的水化物之间能反应 | |
| D. | Z的氧化物不止一种 |
16.石墨和金刚石都是碳的单质,石墨在一定条件下可转化为金刚石.已知12g石墨完全转化为金刚石时,要吸收E kJ的能量,下列说法正确的是( )
| A. | 石墨不如金刚石稳定 | |
| B. | 金刚石和石墨互为同位素 | |
| C. | 石墨能量高于金刚石 | |
| D. | 等质量的金刚石与石墨完全燃烧,石墨放出的能量少 |
13.化学反应A(g)+3B(g)=2C(g)+2D(g),下列四个选项是不同的情况下测得的不同物质的反应速率,其中表示该化学反应的反应速率最快的是( )
| A. | υ(A)=0.20mol/(L•min) | B. | υ(B)=0.45 mol/(L•min) | ||
| C. | υ(C)=0.30 mol/(L•min) | D. | υ(D)=0.35 mol/(L•min) |
17.下列关于物质性质变化的比较,不正确的是( )
| A. | 原子半径大小:Na>S>O | B. | 稳定性:HI>HBr>HCl>HF | ||
| C. | 碱性强弱:KOH>Ca(0H)2>Mg(OH)2 | D. | 还原性强弱:I一>CI一>F? |
11.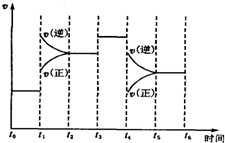 已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.
已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.
(1)该反应的化学平衡常数K与温度T的关系如下
其中K1> K2 (填“>”“<”或“=”)
(2)合成氨在农业和国防中有很重要的意义,在实际生产中,常采用下列措施,其中可以用勒夏特列原理解释的是BD
A.用铁触媒加快化学反应速率
B.采用较高压强(20MPa~50MPa )
C.采用较高温度 (400℃~500℃)
D.将生成的氨液化并及时从体系中分离出来
(3)在某一温度下,向体积不变的容器中加入2molN2、8molH2及固体催化剂,平衡时,容器内气体压强为起始的80%,反应达到平衡时,N2的转化率是50%,此时反应放出的热量=92.2kJ(填“>”“<”或“=”)
(4)在某段时间t0~t6中反应速率与时间的曲线图如下,则氨百分含量最高的时间段A
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(5)t1时刻改变的条件是,升高温度;t3时刻改变的条件是:加入催化剂;t4时刻改变的条件是减小压强.
 已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.
已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.(1)该反应的化学平衡常数K与温度T的关系如下
| T/K | 473 | 573 | 673 | … |
| K | 4.4×10-2 | K1 | K2 | … |
(2)合成氨在农业和国防中有很重要的意义,在实际生产中,常采用下列措施,其中可以用勒夏特列原理解释的是BD
A.用铁触媒加快化学反应速率
B.采用较高压强(20MPa~50MPa )
C.采用较高温度 (400℃~500℃)
D.将生成的氨液化并及时从体系中分离出来
(3)在某一温度下,向体积不变的容器中加入2molN2、8molH2及固体催化剂,平衡时,容器内气体压强为起始的80%,反应达到平衡时,N2的转化率是50%,此时反应放出的热量=92.2kJ(填“>”“<”或“=”)
(4)在某段时间t0~t6中反应速率与时间的曲线图如下,则氨百分含量最高的时间段A
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(5)t1时刻改变的条件是,升高温度;t3时刻改变的条件是:加入催化剂;t4时刻改变的条件是减小压强.
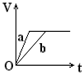
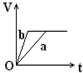
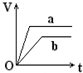
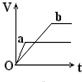
 向足量的a、b两份锌粉中,分别加入少量且等量的稀H2SO4,同时向a中加入少量的CuSO4溶液.下图表示产生H2的体积(V)与时间(t)的关系,其中正确的是( )
向足量的a、b两份锌粉中,分别加入少量且等量的稀H2SO4,同时向a中加入少量的CuSO4溶液.下图表示产生H2的体积(V)与时间(t)的关系,其中正确的是( )