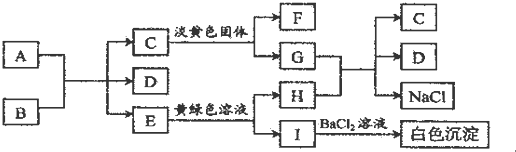
题目内容
18.几种短周期元素的原子半径及主要化合价如下表,下列叙述不正确的是( )| 元素代号 | X | Y | Z | W | T |
| 原子半径/nm | 0.186 | 0.143 | 0.102 | 0.074 | 0.071 |
| 主要化合价 | +1 | +3 | +6、-2 | -2 | -1、无正价 |
| A. | X与W形成的化合物中都只含离子键 | |
| B. | Z的氢化物与T的单质具有相同的核外电子数 | |
| C. | Y、X的最高价氧化物的水化物之间能反应 | |
| D. | Z的氧化物不止一种 |
分析 这几种元素都是短周期元素,T为-1价且没有正化合价,则T是F元素;
Z、W都含有-2价,则为VIA族元素,原子半径Z>W,所以Z是S、W是O元素;
X的主要化合价为+1价,为第IA族元素,原子半径大于Z,所以为Na元素;
Y的主要化合价为+3价,为第IIIA族元素,原子半径大于Z,所以为Al元素;
A.X、W分别是Na、O元素,二者形成的化合物有Na2O、Na2O2;
B.Z是S元素、T是F元素,硫化氢分子中电子数是18、氟气分子中电子数也是18;
C.X、Y分别是Na、Al元素,Na的最高价氧化物的水化物是NaOH,Al元素最高价氧化物是水化物是氢氧化铝,属于两性氢氧化物;
D.Z为S元素,其氧化物有二氧化硫、三氧化硫.
解答 解:这几种元素都是短周期元素,T为-1价且没有正化合价,则T是F元素;
Z、W都含有-2价,则为VIA族元素,原子半径Z>W,所以Z是S、W是O元素;
X的主要化合价为+1价,为第IA族元素,原子半径大于Z,所以为Na元素;
Y的主要化合价为+3价,为第IIIA族元素,原子半径大于Z,所以为Al元素;
A.X、W分别是Na、O元素,二者形成的化合物有Na2O、Na2O2,Na2O中只含离子键、Na2O2中含有离子键和共价键,所以化学键类型不同,故A错误;
B.Z是S元素、T是F元素,硫化氢分子中电子数是18、氟气分子中电子数也是18,所以二者电子数相等,故B正确;
C.X、Y分别是Na、Al元素,Na的最高价氧化物的水化物是NaOH,Al元素最高价氧化物是水化物是氢氧化铝,属于两性氢氧化物,氢氧化铝和NaOH溶液反应生成偏铝酸钠和水,故C正确;
D.Z为S元素,其氧化物有二氧化硫、三氧化硫,所以其氧化物不止一种,故D正确;
故选A.
点评 本题考查位置结构性质相互关系及应用,侧重考查元素化合物结构、性质,知道氢氧化铝的两性、过氧化钠中的化学键类型,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | (CH3)3COH | B. | 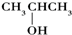 | C. | 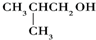 | D. | CH3CH2CH(CH3)OH |
①离子晶体中都存在离子键,肯定没有共价键
②分子晶体中都存在共价键,肯定没有离子键
③金刚石、SiC、NaF、NaCl、H2O、H2Se晶体的熔点依次降低
④在晶体中只要有阴离子就一定有阳离子
⑤金属晶体的熔点普遍都很高
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦分子晶体中分子间作用力越大,分子越稳定.
| A. | ①②③⑥ | B. | ②④⑥ | C. | ③⑤⑥⑦ | D. | ③④ |

关于它们的说法中正确的是( )
| A. | X能发生取代反应、酯化反应、加成反应和水解反应 | |
| B. | Y分子中的所有碳原子不可能共平面 | |
| C. | X、Y均能与溴水反应 | |
| D. | X、Y均能与饱和碳酸钠溶液反应放出CO2 |
| A. | 25.0mL | B. | 35.0mL | C. | 17.5mL | D. | 7.5mL |
| 选项 | 实验目的 | 实验操作 |
| A | 检验蔗糖水解产物中的葡萄糖 | 取1ml 20%蔗糖溶液,加入少量稀硫酸,水浴加热后取少量溶液,加入几滴新制Cu(OH)2,加热 |
| B | 除去乙烷中混有的少量乙烯 | 将混合气体通入足量酸性KMnO4溶液中 |
| C | 验证Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2ml 1mol/L NaOH溶液中加入几滴1mol/L MgCl2溶液,生成白色沉淀,再加入几滴1mol/LFeCl3 |
| D | 硅酸胶体的制备 | 向Na2SiO3溶液(饱和溶液1:2用水稀释)中加入几滴酚酞,再逐滴滴入盐酸,边加边震荡,至溶液红色变浅并接近消失 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 金属钠着火,不能用泡沫灭火器扑火 | |
| B. | 实验台上的酒精灯碰翻着火,立即用湿抹布扑火 | |
| C. | 皮肤溅上浓硫酸,立即用大量水冲洗 | |
| D. | 汞洒落地面,应立即撒上一层硫磺粉 |
| A. | 某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 | |
| B. | 碘水与碘化钾淀粉试纸作用出现蓝色,说明碘具有氧化性 | |
| C. | 往饱和Na2CO3溶液中通入CO2有固体析出,说明NaHCO3溶解度小于Na2CO3 | |
| D. | 同温下,等物质的量浓度的Al2(SO4)3比MgSO4溶液的pH小,说明镁比铝的金属性强 |