题目内容
20.某元素原子的价电子构型为3d104s2,它属于第四周期,是ⅡB族,是ds区元素,元素符号是Zn.分析 价电子构型为3d104s2,应位于第4周期ⅡB族;ⅠA、ⅡA族最后填充s电子,为s区;ⅢA~零族为p区,第ⅢB~ⅤⅡB族和第ⅤⅢ为d区;ⅠB和ⅡB族为ds区,Zn元素位于周期表ds区.
解答 解:价电子构型为3d104s2,所以该元素的基态原子核外电子排布式为1s22s22p63s23p63d104s2,根据电子排布式知,该原子含有4个能层,所以位于第四周期,其价电子排布式为3d104s2,属于第ⅡB族元素,为Zn元素,位于周期表ds区,
故答案为:四;ⅡB;ds;Zn.
点评 本题考查元素周期表的结构、原子结构与位置关系、原子核外电子的排布等,题目难度中等,注意整体把握元素周期表,注意掌握原子核外电子的排布规律.

练习册系列答案
相关题目
10.下列实验操作能达到实验目的是 ( )
| 选项 | 实验目的 | 实验操作 |
| A | 检验蔗糖水解产物中的葡萄糖 | 取1ml 20%蔗糖溶液,加入少量稀硫酸,水浴加热后取少量溶液,加入几滴新制Cu(OH)2,加热 |
| B | 除去乙烷中混有的少量乙烯 | 将混合气体通入足量酸性KMnO4溶液中 |
| C | 验证Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2ml 1mol/L NaOH溶液中加入几滴1mol/L MgCl2溶液,生成白色沉淀,再加入几滴1mol/LFeCl3 |
| D | 硅酸胶体的制备 | 向Na2SiO3溶液(饱和溶液1:2用水稀释)中加入几滴酚酞,再逐滴滴入盐酸,边加边震荡,至溶液红色变浅并接近消失 |
| A. | A | B. | B | C. | C | D. | D |
8.下列有关实验的叙述不正确的是( )
| A. | 某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 | |
| B. | 碘水与碘化钾淀粉试纸作用出现蓝色,说明碘具有氧化性 | |
| C. | 往饱和Na2CO3溶液中通入CO2有固体析出,说明NaHCO3溶解度小于Na2CO3 | |
| D. | 同温下,等物质的量浓度的Al2(SO4)3比MgSO4溶液的pH小,说明镁比铝的金属性强 |
12.下列物质中可用来干燥NH3的是( )
| A. | 浓H2SO4 | B. | 碱石灰 | C. | P2O5 | D. | 无水CaCl2 |
9.短周期主族元素X、Y、Z、W的原子序数依次增大.X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族.下列说法正确的是( )
| A. | 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| C. | X的最高价氧化物对应水化物的酸性比W的强 | |
| D. | Y的气态简单氢化物的热稳定性比W的强 |
3.制备氢气通常有下列四种方法.a.电解水制氢:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑
b.高温使水分解制氢:2H2O$\frac{\underline{\;高温\;}}{\;}$2H2↑+O2↑
c.太阳光催化分解水制氢:2H2O$\frac{\underline{\;\;\;TiO_{2}\;\;\;}}{太阳光}$2H2↑+O2↑
d.天然气制氢:CH4+H2O$\frac{\underline{\;高温\;}}{\;}$CO+3H2 下列说法正确的是( )
b.高温使水分解制氢:2H2O$\frac{\underline{\;高温\;}}{\;}$2H2↑+O2↑
c.太阳光催化分解水制氢:2H2O$\frac{\underline{\;\;\;TiO_{2}\;\;\;}}{太阳光}$2H2↑+O2↑
d.天然气制氢:CH4+H2O$\frac{\underline{\;高温\;}}{\;}$CO+3H2 下列说法正确的是( )
| A. | 方法d是最为节能的一种方法 | |
| B. | 方法a~d中,H2O分子中的共价键全部断裂 | |
| C. | H2O、H2O2所含的化学键类型完全相同 | |
| D. | H2O是共价化合物,CH4是离子化合物 |

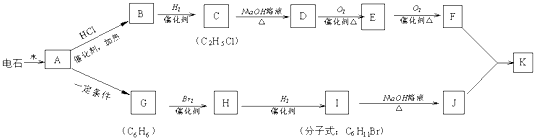
 ;
;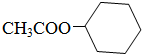 ;
;