题目内容
3.(1)有H、D、T三种原子它们之间的关系是同位素.各1mol的H2、D2、T2三种单质中质子数之比是1:1:1;在标准状况下,1L各种单质中它们的电子数之比是1:1:1.(2)下列过程需要破坏的作用力
①离子键 ②极性共价键 ③非极性共价键 ④氢键 ⑤分子间作用力
A.干冰熔化⑤ B.氢氧化钠溶于水① C.过氧化钠溶于水①③
D.氯化氢气体溶于水② E.冰熔化②④
(3)由铜片、锌片和200mL稀硫酸组成的原电池中,当铜片上放出3.36L(标准状况)气体时硫酸恰好反应完.则消耗金属的质量9.75 g;0.3mol 电子通过了导线;稀硫酸溶液的物质的量浓度是0.75mol/L.
分析 (1)H、D、T三种原子的质子数相同,中子数分别为0、1、2;质子数等于电子数;
(2)A.干冰熔化,化学键不变;
B.氢氧化钠溶于水,发生电离;
C.过氧化钠溶于水,发生化学变化生成NaOH和氧气,离子键和非极性共价键断裂;
D.氯化氢气体溶于水,发生电离;
E.冰熔化,状态改变,且冰中含氢键;
(3)由铜片、锌片和200mL稀硫酸组成的原电池中,Zn为负极,正极上生成氢气,结合2e-~H2~H2SO4计算.
解答 解:(1)H、D、T三种原子的质子数相同,中子数分别为0、1、2,互为同位素;各1mol的H2、D2、T2三种单质中质子数均为2mol,则质子数之比是1:1:1,且质子数等于电子数,则标准状况下,1L各种单质的物质的量相同,它们的电子数之比是1:1:1,
故答案为:同位素;1:1:1;1:1:1;
(2)A.干冰熔化,化学键不变,只破坏分子间作用力,故答案为:⑤;
B.氢氧化钠溶于水,发生电离,离子键断裂,故答案为:①;
C.过氧化钠溶于水,发生化学变化生成NaOH和氧气,离子键和非极性共价键断裂,故答案为:①③;
D.氯化氢气体溶于水,发生电离,H-Cl断裂,故答案为:②;
E.冰熔化,状态改变,且冰中含氢键,则破坏氢键和极性共价键,故答案为:②④;
(3)由铜片、锌片和200mL稀硫酸组成的原电池中,铜片上放出3.36L(标准状况)气体,气体的物质的量为$\frac{3.36L}{22.4L/mol}$=0.15mol,由Zn~2e-~H2~H2SO4可知,消耗金属的质量为0.15mol×65g/mol=9.75g,转移电子为0.15mol×2=0.3mol,稀硫酸溶液的物质的量浓度是$\frac{0.15mol}{0.2L}$=0.75mol/L,
故答案为:9.75;0.3;0.75.
点评 本题考查较综合,涉及化学键、原电池及物质的量的计算,为高频考点,把握化学键的形成、物质构成及原电池为解答的关键,综合性较强,题目难度中等.

 精英口算卡系列答案
精英口算卡系列答案
关于它们的说法中正确的是( )
| A. | X能发生取代反应、酯化反应、加成反应和水解反应 | |
| B. | Y分子中的所有碳原子不可能共平面 | |
| C. | X、Y均能与溴水反应 | |
| D. | X、Y均能与饱和碳酸钠溶液反应放出CO2 |
| A. | 升高温度 | B. | 增加A的物质的量 | ||
| C. | 使用催化剂 | D. | 缩小容器体积使压强增大 |
| A. | 全部 | B. | ①②③⑤ | C. | ①②③ | D. | ①②③④ |
| A. | 某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 | |
| B. | 碘水与碘化钾淀粉试纸作用出现蓝色,说明碘具有氧化性 | |
| C. | 往饱和Na2CO3溶液中通入CO2有固体析出,说明NaHCO3溶解度小于Na2CO3 | |
| D. | 同温下,等物质的量浓度的Al2(SO4)3比MgSO4溶液的pH小,说明镁比铝的金属性强 |
| A. | 浓H2SO4 | B. | 碱石灰 | C. | P2O5 | D. | 无水CaCl2 |
| A. | 按系统命名法,有机物 的名称是2,2,4,5-四甲基-3,3-二乙基己烷 的名称是2,2,4,5-四甲基-3,3-二乙基己烷 | |
| B. | 苯、甲苯、二甲苯互为同系物,均能使酸性高锰酸钾溶液褪色 | |
| C. | 等质量的苯、乙炔、乙烯和甲烷分别在氧气中充分燃烧,所消耗的氧气的量依次增加 | |
| D. | 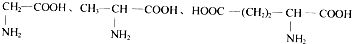 三种氨基酸之间脱水,最多可生成6种二肽 三种氨基酸之间脱水,最多可生成6种二肽 |
