题目内容
17.下列关于物质性质变化的比较,不正确的是( )| A. | 原子半径大小:Na>S>O | B. | 稳定性:HI>HBr>HCl>HF | ||
| C. | 碱性强弱:KOH>Ca(0H)2>Mg(OH)2 | D. | 还原性强弱:I一>CI一>F? |
分析 A、电子层越多半径越大,电子层相同时原子序数越大半径越小;
B、同主族从上到下非金属性减弱,氢化物稳定性减弱;
C、金属性越强,对应的最高价氧化物对应水化物的碱性越强;
D、非金属性越强,其阴离子的还原性越弱.
解答 解:A、电子层越多半径越大,电子层相同时原子序数越大半径越小,Na、S同周期,所以半径Na>S,O元素为上周期元素,所以半径Na>S>O,故A正确;
B、同主族从上到下非金属性减弱,氢化物稳定性减弱,所以稳定性:HF>HCl>HBr>HI,故B错误;
C、金属性越强,对应的最高价氧化物对应水化物的碱性越强,金属性:K>C啊>Mg,则碱性强弱:KOH>Ca(0H)2>Mg(OH)2,故C正确;
D、非金属性越强,其阴离子的还原性越弱,非金属性:F>Cl>I,则还原性强弱:I->CI->F?,故D正确;
故选B.
点评 本题考查了元素周期律,注意把握周期表中元素性质的递变规律,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.实验室做化学实验,发生下列事故,处理方法不正确的是( )
| A. | 金属钠着火,不能用泡沫灭火器扑火 | |
| B. | 实验台上的酒精灯碰翻着火,立即用湿抹布扑火 | |
| C. | 皮肤溅上浓硫酸,立即用大量水冲洗 | |
| D. | 汞洒落地面,应立即撒上一层硫磺粉 |
8.下列有关实验的叙述不正确的是( )
| A. | 某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 | |
| B. | 碘水与碘化钾淀粉试纸作用出现蓝色,说明碘具有氧化性 | |
| C. | 往饱和Na2CO3溶液中通入CO2有固体析出,说明NaHCO3溶解度小于Na2CO3 | |
| D. | 同温下,等物质的量浓度的Al2(SO4)3比MgSO4溶液的pH小,说明镁比铝的金属性强 |
12.下列物质中可用来干燥NH3的是( )
| A. | 浓H2SO4 | B. | 碱石灰 | C. | P2O5 | D. | 无水CaCl2 |
2.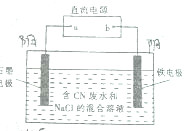 工业上,在强碱性条件下用电解法除去废水中的CN-,装制如图所示,依次发生的反应有:
工业上,在强碱性条件下用电解法除去废水中的CN-,装制如图所示,依次发生的反应有:
①CN--2e-+2OH-═CNO-+H2O
②2Cl--2e-═Cl2↑
③3Cl2+2CNO-+8OH-═N2+6Cl-+2CO32-+4H2O
下列说法不正确的是( )
 工业上,在强碱性条件下用电解法除去废水中的CN-,装制如图所示,依次发生的反应有:
工业上,在强碱性条件下用电解法除去废水中的CN-,装制如图所示,依次发生的反应有:①CN--2e-+2OH-═CNO-+H2O
②2Cl--2e-═Cl2↑
③3Cl2+2CNO-+8OH-═N2+6Cl-+2CO32-+4H2O
下列说法不正确的是( )
| A. | a是电源的正极 | |
| B. | 铁电极上发生的电极反应式为2H++2e-═H2↑ | |
| C. | 为了使电解池连续工作,需要不断补充NaOH | |
| D. | 除去1mol CN-,电解过程中共产生标准状况下11.2L气体 |
9.短周期主族元素X、Y、Z、W的原子序数依次增大.X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族.下列说法正确的是( )
| A. | 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| C. | X的最高价氧化物对应水化物的酸性比W的强 | |
| D. | Y的气态简单氢化物的热稳定性比W的强 |
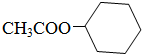
20.佳味备醇存在于槟榔子叶中,其结构如右: 下列有关佳味备醇的说法中不正确的是( )
下列有关佳味备醇的说法中不正确的是( )
 下列有关佳味备醇的说法中不正确的是( )
下列有关佳味备醇的说法中不正确的是( )| A. | 佳味备醇含有一个苯环,它是一种芳香族化合物 | |
| B. | 佳味备醇可以与溴水发生加成和取代反应,还能与氯化铁溶液发生显色反应 | |
| C. | 佳味备醇分子中至少有十二个原子在同一平面上 | |
| D. | 1mol佳味备醇分别与氢气、溴水反应时,最多消耗4molH2,4molBr2 |
 ;
; ;
; ②H20
②H20 ③O=C=O
③O=C=O ④CCl4
④CCl4 ⑤Fe2+Fe2+⑥N2
⑤Fe2+Fe2+⑥N2
 .
.