题目内容
19. 向足量的a、b两份锌粉中,分别加入少量且等量的稀H2SO4,同时向a中加入少量的CuSO4溶液.下图表示产生H2的体积(V)与时间(t)的关系,其中正确的是( )
向足量的a、b两份锌粉中,分别加入少量且等量的稀H2SO4,同时向a中加入少量的CuSO4溶液.下图表示产生H2的体积(V)与时间(t)的关系,其中正确的是( )| A. | 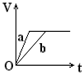 | B. | 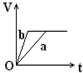 | C. | 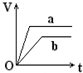 | D. | 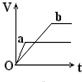 |
分析 Zn和硫酸铜反应生成硫酸锌,Zn、Cu和稀硫酸构成原电池,增大反应速率,因为锌过量,则生成的氢气体积相等,据此分析解答.
解答 解:等质量的两份锌粉a、b,分别加入过量的稀H2SO4中,同时向a中放入少量的CuSO4溶液,发生:Zn+Cu2+=Zn2++Cu,形成原电池,反应速率增大,反应用时少于b,因为锌过量,稀硫酸等量,所以生成氢气的量相等,其图象为 ,故选A.
,故选A.
点评 本题考查化学反应速率影响因素、化学反应计算等知识点,明确原电池能增大反应速率是解本题关键,注意该反应中是锌过量,如果是稀硫酸过量则应该选D.

练习册系列答案
相关题目
9.下列醇能被氧化为醛类化合物的是( )
| A. | (CH3)3COH | B. | 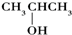 | C. | 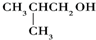 | D. | CH3CH2CH(CH3)OH |
10.下列实验操作能达到实验目的是 ( )
| 选项 | 实验目的 | 实验操作 |
| A | 检验蔗糖水解产物中的葡萄糖 | 取1ml 20%蔗糖溶液,加入少量稀硫酸,水浴加热后取少量溶液,加入几滴新制Cu(OH)2,加热 |
| B | 除去乙烷中混有的少量乙烯 | 将混合气体通入足量酸性KMnO4溶液中 |
| C | 验证Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2ml 1mol/L NaOH溶液中加入几滴1mol/L MgCl2溶液,生成白色沉淀,再加入几滴1mol/LFeCl3 |
| D | 硅酸胶体的制备 | 向Na2SiO3溶液(饱和溶液1:2用水稀释)中加入几滴酚酞,再逐滴滴入盐酸,边加边震荡,至溶液红色变浅并接近消失 |
| A. | A | B. | B | C. | C | D. | D |
7.实验室做化学实验,发生下列事故,处理方法不正确的是( )
| A. | 金属钠着火,不能用泡沫灭火器扑火 | |
| B. | 实验台上的酒精灯碰翻着火,立即用湿抹布扑火 | |
| C. | 皮肤溅上浓硫酸,立即用大量水冲洗 | |
| D. | 汞洒落地面,应立即撒上一层硫磺粉 |
14.反应A(s)+B(g)?c(g)在密闭容器中进行,下列情况不能使反应速率加快的是( )
| A. | 升高温度 | B. | 增加A的物质的量 | ||
| C. | 使用催化剂 | D. | 缩小容器体积使压强增大 |
8.下列有关实验的叙述不正确的是( )
| A. | 某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 | |
| B. | 碘水与碘化钾淀粉试纸作用出现蓝色,说明碘具有氧化性 | |
| C. | 往饱和Na2CO3溶液中通入CO2有固体析出,说明NaHCO3溶解度小于Na2CO3 | |
| D. | 同温下,等物质的量浓度的Al2(SO4)3比MgSO4溶液的pH小,说明镁比铝的金属性强 |
9.短周期主族元素X、Y、Z、W的原子序数依次增大.X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族.下列说法正确的是( )
| A. | 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| C. | X的最高价氧化物对应水化物的酸性比W的强 | |
| D. | Y的气态简单氢化物的热稳定性比W的强 |