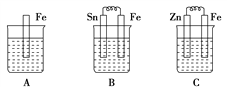
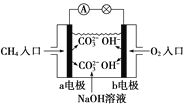
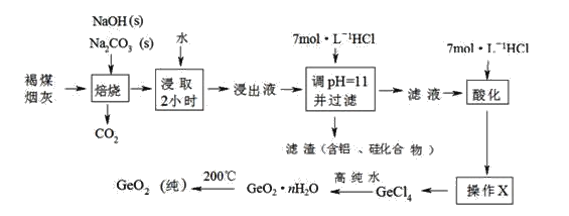
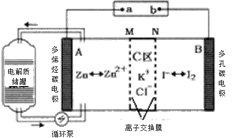
题目内容
【题目】一定质量的混合气体在密闭容器中发生如下反应:xA(g)+yB(s)![]() zC(g)。达到平衡后测得A气体的浓度为0.5mol·L-1。当恒温下将密闭容器的容积扩大到原来的二倍,再达平衡后,测得A的浓度为0.2mol·L-1。下列叙述不正确的是( )
zC(g)。达到平衡后测得A气体的浓度为0.5mol·L-1。当恒温下将密闭容器的容积扩大到原来的二倍,再达平衡后,测得A的浓度为0.2mol·L-1。下列叙述不正确的是( )
A.平衡向正反应方向移动B.z<x+y
C.C的体积分数增大D.A的转化率增大
【答案】B
【解析】
当恒温下将密闭容器的容积扩大到原来的二倍,再达平衡后,测得A的浓度由0.5mol·L-1变为0.2mol·L-1。在改变容积的瞬间,A的浓度应为0.25mol·L-1,现变为0.2mol·L-1,说明平衡正向移动。
A. 由上面分析可知,平衡向正反应方向移动,A正确;
B.减小压强,平衡向气体分子数增大的方向移动,则z >x+y,B不正确;
C. 平衡正向移动,生成物的体积增大,所以产物C的体积分数增大,C正确;
D. 平衡正向移动,反应物转化的量增多,所以A的转化率增大,D正确。
故选B。

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目