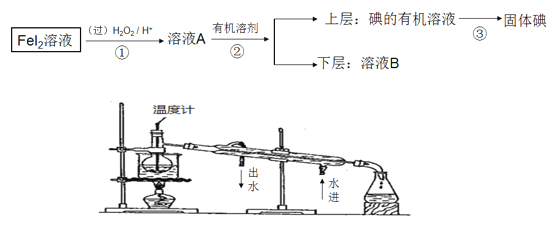
题目内容
【题目】(1)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
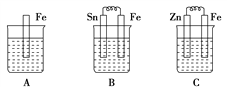
①B中Sn极的电极反应式为_______;Sn极附近溶液的pH(填“增大”、“减小”或“不变”)______。
②C中总反应离子方程式为_______________。
③比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是________________。
(2)如图是甲烷燃料电池原理示意图,回答下列问题:
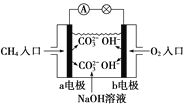
①电池的负极是________(填“a”或“b”)电极,该极的电极反应是:_______________________。
②常温下,如果该原电池电解质溶液为pH=13的氢氧化钠500mL,构成原电池一段时间后pH变为12,则构成原电池消耗了标准状况下__________ mL甲烷,(假设化学能全部转化为电能,忽略氢氧化钠溶液的体积变化)
【答案】 2H++2e-=H2↑ 增大 Zn+2H+=Zn2++H2 B>A>C a CH4-8e-+10OH-=CO32-+7H2O 504
【解析】⑴. ①.在B装置中,Fe为负极,Sn为正极,在正极上氢离子放电生成氢气,则在Sn极的电极反应式为:2H++2e-=H2↑;在Sn电极,因消耗H+,故pH增大;故答案为:2H++2e-=H2↑;增大;
②.在C装置中,Zn易失电子作负极,Fe作正极,本原电池装置实质上相当于锌和氢离子之间的置换反应,则总反应方程式为:Zn+2H+=Zn2++H2↑,故答案为:Zn+2H+=Zn2++H2↑;
③.在A装置中,Fe发生化学腐蚀,B装置中Fe为负极,Sn为正极,Fe被腐蚀,C装置中Zn为负极,Fe为正极,Fe受到保护,因腐蚀速率:原电池引起的腐蚀>化学腐蚀>受到保护的腐蚀,故答案为:B>A>C;
⑵. ①.在燃料电池中,通入燃料的电极是负极,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水,所以a极是负极,电极反应式为:CH4-8e-+10OH-=CO32-+7H2O,故答案是:a;CH4-8e-+10OH-=CO32-+7H2O;
②.常温下,pH=13的NaOH溶液中c(OH-)=0.1mol/L,pH=12的NaOH溶液中c(OH-)=0.01mol/L,该原电池的总反应式为:CH4+2O2+2OH-=CO32-+3H2O,构成原电池一段时间后,NaOH溶液中氢氧根离子减少了n(OH-)=0.5L×0.1mol/L-0.5L×0.01mol/L=0.045mol,根据总反应式,则消耗标准状况下甲烷的体积是:0.045mol÷2×22.4L/mol=0.504L,即504mL,故答案是:504。