题目内容
【题目】2019年,我国科学家研发出一种新型的锌碘单液流电池,已知M为阴离子交换膜,其原理如图所示。下列说法不正确的是
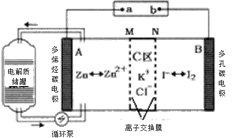
A.放电时A电极反应式为:Zn-2e﹣= Zn2+
B.充电时,B极与外接电源正极相连
C.放电时电解质储罐中离子浓度增大
D.放电时当A极减少65g时,C区Cl﹣增加2NA
【答案】D
【解析】
由装置图可知,放电时,A极:Zn是负极,电极反应式为Zn-2e-═Zn2+,B极:石墨是正极,电极反应式为I2+2e-=2I-,据此分析解答。
A. 放电时,A极:Zn是负极,电极反应式为Zn-2e-═Zn2+,故A正确;
B. 放电时,B极是正极,故充电时,B极相当于电解池的阳极,与外接电源正极相连,故B正确;
C. 放电时,A极是负极,电极反应式为Zn-2e-═Zn2+,所以储罐中的离子总浓度增大,故C正确;
D. 放电时,A极电极反应式为Zn-2e-═Zn2+,A极减小65g,即1mol锌,则负极区生成1mol Zn2+、正电荷增加,M为阴离子交换膜,所以会有2molCl通过M膜进入负极,所以C区Cl﹣减少2NA,故D错误;
答案选D。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】![]() 时,在
时,在![]() 的密闭容器中充入
的密闭容器中充入![]() 和
和![]() ,一定条件下发生反应:
,一定条件下发生反应:![]() ,测得
,测得![]() 和
和![]() 的浓度随时间变化如下表所示。下列说法不正确的是
的浓度随时间变化如下表所示。下列说法不正确的是
时间 |
|
|
|
| 6 | 0 | ? |
| 3 | 1 |
|
A.![]() 时间内
时间内![]()
B.![]() 时,若升高温度或再充入
时,若升高温度或再充入![]() 气体,都可以提高
气体,都可以提高![]() 的转化率
的转化率
C.![]() 时,
时,![]() 正
正![]() 逆
逆![]()
D.![]() 时,平衡常数
时,平衡常数![]() ,
,![]() 与
与![]() 的转化率相等
的转化率相等