题目内容
【题目】某工厂利用褐煤烟灰(主要成分为碳、二氧化锗,还有少量氧化铝和二氧化硅)制取纯GeO2的主要流程如下:
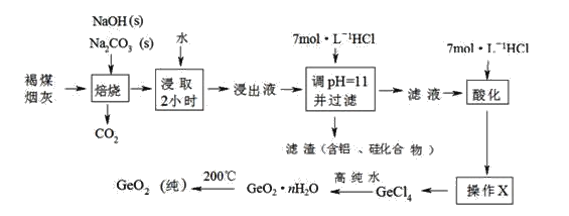
已知:GeO2是一种难溶于水的偏弱酸性的两性氧化物,GeCl4的沸点是83.1℃。
(1)写出二氧化锗与碳酸钠焙烧时发生反应的化学方程式:_______________。
(2)用水浸取焙烧物长达2小时的目的是_______________________。
(3)“酸化”至溶液中盐酸浓度为5.3 mol·L-1时有利于生成四氯化锗,写出该反应的化学方程式:_____________。
(4)若滤液“酸化”时酸度不够,溶液会出现明显的浑浊,原因是_____________________。
(5)操作“X”的名称为________________。
(6)四氯化锗与高纯水反应的化学方程式为__________________。
【答案】Na2CO3+ GeO2![]() Na2GeO3+ CO2↑ 为了提高含锗化合物的浸出率 Na2GeO3+ 6HCl = GeCl4+ 2NaCl + 3H2O 生成了H2GeO3(或GeO2或GeO2·nH2O)沉淀 蒸馏 GeCl4+ (2+n)H2O = GeO2·nH2O +4HCl
Na2GeO3+ CO2↑ 为了提高含锗化合物的浸出率 Na2GeO3+ 6HCl = GeCl4+ 2NaCl + 3H2O 生成了H2GeO3(或GeO2或GeO2·nH2O)沉淀 蒸馏 GeCl4+ (2+n)H2O = GeO2·nH2O +4HCl
【解析】
(1)根据题干信息可以判断:反应物为GeO2、Na2CO3,生成物为Na2GeO3、CO2,反应条件为加热,据此写出反应的化学方程式;
(2)水浸取焙烧物的时间较长,可以使焙烧物中含锗化合物尽可能溶解;
(3)类比偏铝酸钠与盐酸的反应,根据题干信息判断反应物、生成物,然后写出反应的化学方程式;
(4)如果酸度不够,锗酸钠与氢离子反应生成了生成了H2GeO3(或GeO2或GeO2nH2O),生成了H2GeO3(或GeO2或GeO2nH2O)水中溶解度不大,所以出现浑浊现象;
(5)溶液中分离易溶物,可以根据沸点不同利用蒸馏法分离;
(6)根据反应流程可知,四氯化锗与高纯水反应生成GeO2nH2O,根据质量守恒定律写出该反应方程式。
(1)根据反应流程可知,碳酸钠与二氧化锗反应生成锗酸钠和二氧化碳,反应的化学方程式为:GeO2+Na2CO3![]() Na2GeO3+CO2↑;
Na2GeO3+CO2↑;
(2)用水浸取焙烧物长达2小时的目的是为了尽可能使焙烧混合物中的含锗化合物溶于水,=从而提高含锗化合物的浸出率;
(3)GeO2是一种难溶于水的偏弱酸性的两性氧化物,类比氢氧化铝的性质,则H2GeO3能够与氯化氢反应生成生成物为GeCl4、NaCl和水,反应的化学方程式为:Na2GeO3+6HCl=2NaCl+3H2O+GeCl4;
(4)若滤液“酸化”时酸度不够,Na2GeO3与氢离子反应生成了生成了H2GeO3(或GeO2或GeO2nH2O),生成了H2GeO3(或GeO2或GeO2nH2O)在水中溶解度较小,所以溶液会出现明显的浑浊;
(5)GeCl4的沸点是83.1℃,其沸点较低,从溶液中分离出GeCl4,可以通过蒸馏操作操作完成;
(6)根据制备流程可知,GeCl4与高纯水反应生成GeO2nH2O,另一种产物为HCl,则反应的化学方程式为:GeCl4+(2+n)H2O=4HCl+GeO2nH2O。

 口算能手系列答案
口算能手系列答案