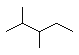
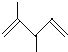
题目内容
【题目】将V1mL未知浓度的NaOH溶液和V2mL1.50mol·L-1HCl混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是( )

A.由图可知,做该实验时环境温度为22℃
B.该实验表明反应中化学能只能转化为热能
C.NaOH溶液的浓度约是1.00mol·L-1
D.该实验表明有水生成的反应都是放热反应
【答案】C
【解析】
A. 由图可知,温度为22℃是5mL未知浓度的NaOH溶液和45mL1.50mol·L-1HCl混合均匀后测量并记录的溶液温度,而不是实验时的环境温度,A错误;
B. 该实验表明反应中化学能转化为热能,但并没有表明反应中化学能只能转化为热能,B错误;
C. V1=30mL时,混合溶液的温度最高,则表明二者刚好完全反应,30mL×c(NaOH)=20mL×1.50mol·L-1,从而得出NaOH溶液的浓度约是1.00mol·L-1,C正确;
D. 该反应为放热反应,有水生成,但并不能说明有水生成的反应都是放热反应,D错误。
故选C。

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案
相关题目
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 | |
B | 浓氨水 | 碱石灰 | AgNO3溶液 | AgOH具有两性 | |
C | 浓硫酸 | Na2SO3 | FeCl3溶液 | SO2具有还原性 | |
D | 稀盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
A.AB.BC.CD.D
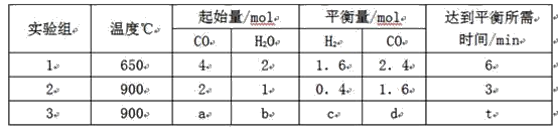
【题目】![]() 时,在
时,在![]() 的密闭容器中充入
的密闭容器中充入![]() 和
和![]() ,一定条件下发生反应:
,一定条件下发生反应:![]() ,测得
,测得![]() 和
和![]() 的浓度随时间变化如下表所示。下列说法不正确的是
的浓度随时间变化如下表所示。下列说法不正确的是
时间 |
|
|
|
| 6 | 0 | ? |
| 3 | 1 |
|
A.![]() 时间内
时间内![]()
B.![]() 时,若升高温度或再充入
时,若升高温度或再充入![]() 气体,都可以提高
气体,都可以提高![]() 的转化率
的转化率
C.![]() 时,
时,![]() 正
正![]() 逆
逆![]()
D.![]() 时,平衡常数
时,平衡常数![]() ,
,![]() 与
与![]() 的转化率相等
的转化率相等