题目内容
【题目】某复合肥的主要成分有KCl、NH4H2PO4和CO(NH2)2等。测定该复合肥中氮的质量分数的实验步骤如下:
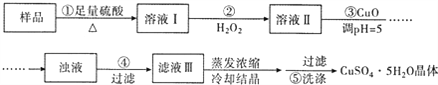
步骤1:准确称取0.5000 g样品于锥形瓶中,加入足量浓硫酸并加热,不再有CO2溢出时,冷却至室温。
步骤2:向锥形瓶中加入100mL蒸馏水,再加入适量的CaCl2溶液,并用NaOH溶液调节溶液近中性,过滤,洗涤,得0.1550 gCa3(PO4)2沉淀和滤液A。
步骤3:向滤液A中加入过量的甲醛溶液,加指示剂,用0. 5000 mol/LNaOH标准溶液滴定至终点,消耗NaOH溶液22.00 mL。 [已知:4 NH4++6HCHO=4H++(CH2)6N4+6H2O]
(1)步骤1中,CO(NH2)2与硫酸反应的化学方程式为____________________。
(2)欲使滤液A中c(PO43—)≤4.0×10-6mol/L,应保持溶液中c(Ca2+)≥______________mol/L[已知KSP[Ca3(PO4)2]=2.0×10-33]。
(3)复合肥样品中N的质量分数为___________。
(4)计算复合肥样品中NH4H2PO4和CO(NH2)2的物质的量之比_____________(写出计算过程)。
【答案】CO(NH2)2+H2SO4+H2O=CO2↑+(NH4)2SO4 5.0×10﹣8 30.8% 1:5
【解析】
(1)CO(NH2)2与硫酸反应生成硫酸铵和二氧化碳气体;
(2)根据Ksp[Ca3(PO4)2]=c3(Ca2+)×c2(PO43-)计算;
(3)根据关系式n(N)~n(NH4+)~n(H+)~n(NaOH)计算;
(4)根据Ca3(PO4)2的质量可知NH4H2PO4的物质的量,根据N元素守恒可知CO(NH2)2的物质的量,进而可计算二者的物质的量之比。
(1)CO(NH2)2与硫酸反应生成硫酸铵和二氧化碳气体,反应的方程式为CO(NH2)2+H2SO4+H2O=CO2↑+(NH4)2SO4;
(2)由Ksp[Ca3(PO4)2]=c3(Ca2+)×c2(PO43-)可知,c(Ca2+)≥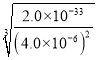 molL-1=5.0×10-8molL-1;
molL-1=5.0×10-8molL-1;
(3)由关系式n(N)~n(NH4+)~n(H+)~n(NaOH)可知,n(N)=0.5000molL-1×0.022L=0.011mol,m(N)=0.011mol×14g/mol=0.154g,ω(N)=![]() ×100%=30.8%;
×100%=30.8%;
(4)n(NH4H2PO4)=n(PO43-)=2n[Ca3(P04)2]=2×![]() =0.001mol,n(CO(NH2)2)=
=0.001mol,n(CO(NH2)2)=![]() [n总(N)-n(NH4H2PO4)]=
[n总(N)-n(NH4H2PO4)]=![]() ×(0.011mol-0.001mol)=0.005mol,则n(NH4H2PO4):n(CO(NH2)2)=1:5。
×(0.011mol-0.001mol)=0.005mol,则n(NH4H2PO4):n(CO(NH2)2)=1:5。

 亮点激活精编提优100分大试卷系列答案
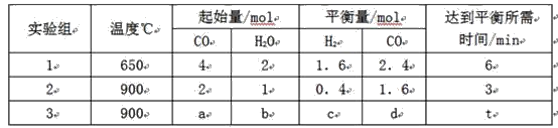
亮点激活精编提优100分大试卷系列答案【题目】![]() 时,在
时,在![]() 的密闭容器中充入
的密闭容器中充入![]() 和
和![]() ,一定条件下发生反应:
,一定条件下发生反应:![]() ,测得
,测得![]() 和
和![]() 的浓度随时间变化如下表所示。下列说法不正确的是
的浓度随时间变化如下表所示。下列说法不正确的是
时间 |
|
|
|
| 6 | 0 | ? |
| 3 | 1 |
|
A.![]() 时间内
时间内![]()
B.![]() 时,若升高温度或再充入
时,若升高温度或再充入![]() 气体,都可以提高
气体,都可以提高![]() 的转化率
的转化率
C.![]() 时,
时,![]() 正
正![]() 逆
逆![]()
D.![]() 时,平衡常数
时,平衡常数![]() ,
,![]() 与
与![]() 的转化率相等
的转化率相等