题目内容
【题目】在体积为a L的密闭容器中,放入2LA气体和1LB气体,在一定条件下发生反应:3A(气)+B(气)nC(气)+2D(气),反应达平衡后,A的浓度减少到原来的![]() ,混合气体的平均相对分子质量增大了
,混合气体的平均相对分子质量增大了![]() 倍,则反应式中的n值为
倍,则反应式中的n值为
A.1B.2C.3D.4
【答案】A
【解析】
设A、B的起始物质的量分别为2mol、1mol,平衡时转化的A为2mol×![]() =1mol,则:
=1mol,则:
3A(气)+B(气)![]() nC(气)+2D(气)
nC(气)+2D(气)
起始量(mol):2 1 0 0
变化量(mol):1 ![]()
![]() n
n ![]()
平衡量(mol):1 ![]()
![]() n
n ![]()
再根据混合气体平均相对分子质量增大了![]() 倍,反应前后均为气体,气体的总质量不变,设混合气体总质量为mg,根据M=
倍,反应前后均为气体,气体的总质量不变,设混合气体总质量为mg,根据M=![]() 可知,
可知,![]() ×(1+
×(1+![]() )=
)=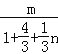 ,解得n=1,故选A。
,解得n=1,故选A。

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
【题目】7000C时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g);反应过程中测定的部分数据见下表(表中t2>t1)
CO2(g)+H2(g);反应过程中测定的部分数据见下表(表中t2>t1)
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法中正确的是
A.反应在t1min内的平均速率为υ(CO2)=![]() mol·L-1·min-1
mol·L-1·min-1
B.到t1min时,反应未达平衡状态
C.保持7000C不变,向平衡体系中再通入0.60molCO和0.30 molH2O,达到新平衡时与原平衡相比,CO转化率增大,H2的体积分数增大
D.温度升至8000C时,上述反应的平衡常数为0.64,则正反应为放热反应



