题目内容
【题目】氮氧化物(NOx)造成酸雨、光化学烟雾、臭氧层破坏等危害,不仅破坏自然生态环境,而且严重危害人类健康。采用合适的还原剂能够实现烟气的高效脱硝。
(1)活性炭还原脱硝可防止氮氧化物污染,已知:
①N2(g)+O2(g)═2NO(g) △H1=+180.5kJmol-1
②2C(s)+O2(g)═2CO(g) △H2=-221.0kJmol-1
③2CO(g)+O2(g)═2CO2(g) △H3=-556.0kJmol-1
则反应C(s)+2NO(g)![]() N2(g)+CO2(g)△H=__kJmol-1
N2(g)+CO2(g)△H=__kJmol-1
(2)用活性炭对NO进行还原,采用相同质量不同粒径的同种催化剂M和N,测量相同时间内烟气的脱氮率,结果如图所示。
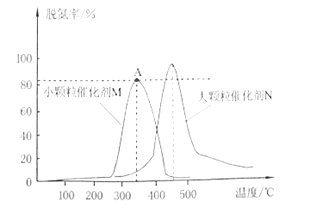
①在M、N两种不同粒径催化剂作用下,出现M和N两条不同的脱氮率与温度的变化曲线的原因是___。
②判断M曲线上最高点A点对应的脱氮率__(填“是“或“不是”)该温度下的平衡脱氮率。
③25℃下,用NaOH溶液作捕提剂吸收产生的CO2,不仅可以降低碳排放,而且可得到重要的化工产品。某次捕捉后得到pH=12的溶液,已知:25℃下Ka2(H2CO3)=5.6×10-11,试通过计算溶液中c(CO32-):c(HCO3-)=__。
(3)在一恒容密闭容器中,使用某种催化剂对反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)△H<0进行相关实验探究。改变投料比(n0(SO2):n0(NO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定SO2的平衡转化率[α(SO2)]。已知:KR=16,KZ=1,部分实验结果如图所示。
SO3(g)+NO(g)△H<0进行相关实验探究。改变投料比(n0(SO2):n0(NO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定SO2的平衡转化率[α(SO2)]。已知:KR=16,KZ=1,部分实验结果如图所示。

①如果要将图中R点的平衡状态改变为X点的平衡状态,应采取的措施是__。
②图中R、X、Y、Z四点对应的实验温度分别为TR、TX、TY,TZ通过计算选择下列选项中两个温度相等是__(填标号)。
A.TR和TY B.TR和TZ C.TX和TZ D.TY和TZ
【答案】2NO(g)+C(s)![]() CO2(g)+N2(g) △H=-569kJ/mol 催化剂粒径越小,其与活性炭的接触面积越大,就越容易被还原,需要的温度较低 不是 56 升高温度 CD
CO2(g)+N2(g) △H=-569kJ/mol 催化剂粒径越小,其与活性炭的接触面积越大,就越容易被还原,需要的温度较低 不是 56 升高温度 CD
【解析】
(1)用焦炭还原NO生成无污染气体,说明生成物是二氧化碳和氮气,
①N2(g)+O2(g)═2NO(g) △H1=+180.5kJmol-1
②2C(s)+O2(g)═2CO(g) △H2=-221.0kJmol-1
③2CO(g)+O2(g)═2CO2(g) △H3=-556.0kJmol-1
将方程式![]() (②+③)-①得2NO(g)+C(s)CO2(g)+N2(g)
(②+③)-①得2NO(g)+C(s)CO2(g)+N2(g)
所以△H=![]() (△H2+△H3)-△H1=
(△H2+△H3)-△H1=![]() (-221.0kJmol-1-556.0kJmol-1)-180.5kJmol-1=-569kJ/mol;
(-221.0kJmol-1-556.0kJmol-1)-180.5kJmol-1=-569kJ/mol;
(2)①催化剂粒径越小,其与活性炭的接触面积越大,就越容易被还原,需要的温度较低;
②根据催化剂N的曲线可知温度升高时可以达到更高的脱氮率,而A点的温度要比催化剂N的曲线最高点的温度要低,该反应为放热反应,降低温度平衡右移,所以A点的对应温度下的平衡脱氮率应该更大,所以A点不是对应温度下的平衡脱氮率;
③pH=12 的溶液,由HCO3-CO32-+H+,可知K2(H2CO3)=5.6×10-11=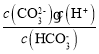 ,则c(CO32-):c(HCO3-)=
,则c(CO32-):c(HCO3-)=![]() ;
;
(3)①如果要将图中R点的平衡状态改变为X点的平衡状态,平衡转化率减小,平衡逆向进行,正反应为放热反应,升高温度平衡逆向进行;
②对应的实验温度分别为TR、TX、TY,TZ,温度和平衡常数有关,结合图中的数据,反应为:NO2(g)+SO2(g)SO3(g)+NO(g),X点时,起始物料比![]() =1.0,SO2的平衡转化率为α(SO2)=50%,设起始时c(NO2)=c(SO2)=xmol/L,化学平衡常数为KX=
=1.0,SO2的平衡转化率为α(SO2)=50%,设起始时c(NO2)=c(SO2)=xmol/L,化学平衡常数为KX=![]() =1,所以KX=KZ=1,则TX=TZ,
=1,所以KX=KZ=1,则TX=TZ,
Y点时,起始物料比为![]() =1.5,SO2的平衡转化率为α(SO2)=40%,设起始时c(SO2)=1.5ymol/L,c(NO2)=ymol/L,化学平衡常数为KY=
=1.5,SO2的平衡转化率为α(SO2)=40%,设起始时c(SO2)=1.5ymol/L,c(NO2)=ymol/L,化学平衡常数为KY=![]() =1,所以KY=KZ=1,
=1,所以KY=KZ=1,
则TY=TZ,所以选CD。

 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案【题目】煤燃烧排放的烟气含有SO2和NO,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)NaClO2中Cl元素的价态为_______。
(2)在鼓泡反应器中通入含有含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1 。反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①在NaClO2溶液脱硝的主要反应中,参加反应的n(ClO2-):n(NO)=_________,增加压强,NO的转化率______(填“提高”“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐_______(填“升高”“不变”或“降低”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
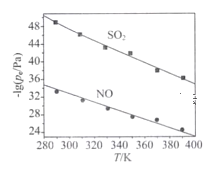
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pc如下图所示:
 =
=
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均____(填“增大”“不变”或“减小”)。
②反应ClO2+2SO32===2SO42+Cl的平衡常数K表达式为___________。